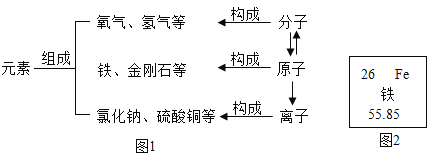
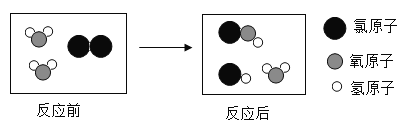
题目内容
【题目】工业上用电解饱和食盐水的方法生产烧碱、氢气、氯气等化工产品,其反应原理为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。某研究性小组对制得的烧碱样品进行了如下探究:
2NaOH+H2↑+Cl2↑。某研究性小组对制得的烧碱样品进行了如下探究:
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)猜想一:样品露置在空气中导致样品可能含有碳酸钠。
猜想二:原料未完全转化导致样品可能含有氯化钠。
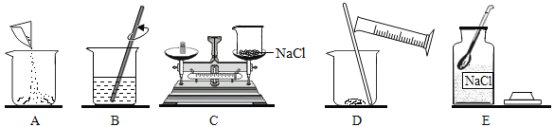
(实验探究)请帮甲同学完成以下探究实验:
猜想 | 实验步骤 | 实验现象 | 实验结论 |
猜想一 | ①取少量烧碱样品于试管中,加水溶解,向其中滴加过量稀硝酸 | 有气泡产生 | __________ |
②将步骤①中产生的气体通入澄清的石灰水中 | 澄清石灰水变浑浊 | ||
猜想二 | ③向步骤①所得的溶液中滴加几滴AgNO3溶液 | ________ | 样品中含有氯化钠 |
(解释与结论)乙同学为了验证猜想一的实验结论,也向烧碱样品的溶液中滴加了少量稀硝酸,却发现无气泡产生。大家经过分析,发现乙同学所用试剂与甲同学相同,却没有看到气泡。原因可能是_________。
(交流与反思)丙同学提出:“在甲同学做的实验中,稀硝酸也可以用稀盐酸代替。”你认为他观点_________(填“正确”或“不正确”)。
【答案】样品中有碳酸钠或猜想一成立 产生白色沉淀 加入少量的稀硝酸全部先和氢氧化钠反应完了 不正确
【解析】
实验探究:
①取少量烧碱样品于试管中,加水溶解,向其中滴加过量稀硝酸,有气泡产生;
②将步骤①中产生的气体通入澄清的石灰水中,澄清石灰水变浑浊,说明有二氧化碳生成;可知碳酸钠和稀硝酸反应生成硝酸钠、水、二氧化碳;因此样品中含有的杂质是碳酸钠,猜想一正确;
③向步骤①所得的溶液中滴加几滴AgNO3溶液,产生白色沉淀,已知硝酸银和氯化钠反应生成氯化银白色沉淀和硝酸钠,说明样品中还含有的杂质是氯化钠;
解释与结论:
少量的稀硝酸先与样品中的氢氧化钠反应,样品中氢氧化钠未反应完之前,稀硝酸不会与碳酸钠反应产生气体;
交流与反思:
上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验。

【题目】实验一:实验室制备二氧化碳的实验如下.
(1)市售浓盐酸的标签局部如图1,为使制备过程中二氧化碳平稳地产生且较纯净,应将该浓盐酸_____.
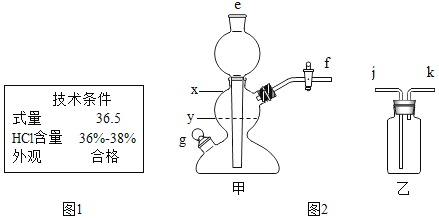
(2)用图2甲装置制备二氧化碳,选择的固体药品是_____(填编号).
a 粉末状石灰石 b 块状大理石
c 粉末状熟石灰 d 块状生石灰
(3)控制所加盐的量,使反应时甲装置内液面位于_____(填“x”或“y”)处为宜.
(4)收集二氧化碳时,应将甲的_____处与乙的_____处连接.(填有关编号)
(5)装置甲也可以用于实验室制取氢气,写出实验室制取氢气的化学方程式_____.
实验二:某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究:
(提出问题)二氧化碳与氢氧化钠反应,还是溶解在水中?
(查阅资料)
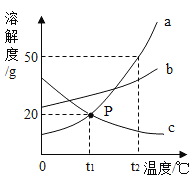
①15℃、101KPa时,二氧化碳的溶解度如表:
②15℃时,在酒精中氢氧化钠易溶、碳酸钠微溶.
③通常情况下,稀溶液的体积约等于溶剂的体积.
溶剂 | 1.0L水 | 1.0L酒精 |
溶解度 | 1.0L | 0.5L |
(实验设计)在15℃、101KPa时,制取二氧化碳并用于下图实验甲、实验乙.
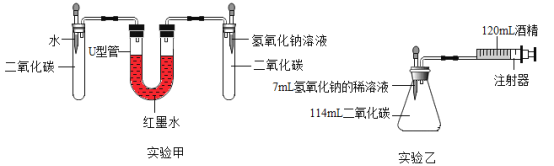
(分析与表达)
(1)二氧化碳与氢氧化钠反应的化学方程式是_____.
(2)实验前,两套装置都进行气密性检查,实验甲装置气密性检查的方法是_____.
(3)实验甲中,同时滴入等体积的水和氢氧化钠溶液后的现象是:右侧液面升高,左侧液面下降,一段时间后,右侧液面缓慢下降,左侧上升,最后右侧液面_____(填“高于”或“低于”)左侧
(4)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶,活塞的移动速度是_____.(填答案字母)实验乙中,还可能观察到的现象是__.
A 先慢后快 B 先快后慢
(5)实验乙中,120mL酒精不能换成水,原因是_____.