题目内容
【题目】如图是对 20℃一定质量的甲的溶液进行恒温蒸发的结晶实验过程,请回答:

(1)蒸发前原溶液是_____(填“饱和”或“不饱和”)溶液,n 的数值是_____。
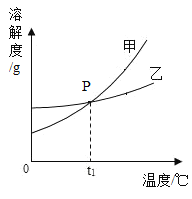
(2)甲、乙两种不含结晶水的固体物质的溶解度曲线如图示,P 点的含义_____。
(3)在 20℃时,将上图乙的不饱和溶液变为饱和溶液,下列有关说法不正确的是______填字母)
A溶剂的质量可能变小 B溶液的质量一定会变
C溶质的质量分数一定变大 D溶质的质量一定不变
【答案】不饱和 11 在t1℃时,甲乙溶解度相等 BCD
【解析】
(1)由图可知饱和甲溶液第二次蒸发10g水析出5g甲,而第一次蒸发10g水只析出1g甲,故刚开始溶液是不饱和溶液,再次蒸发10g水甲会再次析出5g共11g,故填:不饱和;11。
(2)溶解度曲线的交点表示溶解度相等,P 点的含义在t1℃时,甲乙溶解度相等,故填:在t1℃时,甲乙溶解度相等。
(3)在 20℃时,将上图乙的不饱和溶液变为饱和溶液可以蒸发溶剂、降低温度、增加溶质。
A、蒸发溶剂,溶剂的质量变小,A正确。
B、降低温度溶液质量不变,故B错。
C、降低温度,溶质的质量分数不变,故C错。
D、增加溶质,溶质的质量变大,故D错。
故选:BCD。

 小学教材完全解读系列答案
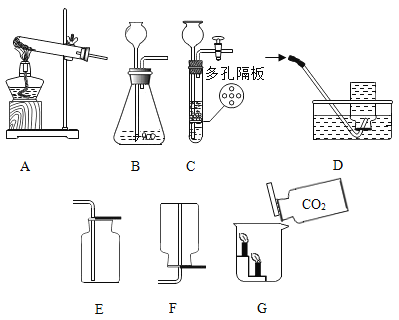
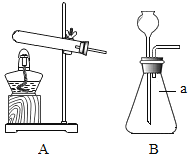
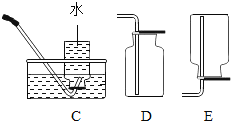
小学教材完全解读系列答案【题目】(1)根据下图的实验装置,回答问题:
发生装置 | 收集装置 | 洗气装置 |
|
|
|
①图B中仪器a的名称_____。
②实验室用加热氯酸钾和二氧化锰混合物制取氧气的化学方程式为:_____,发生和收集装置为_____(填字母)。
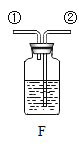
③实验室用石灰石和稀盐酸反应制取二氧化碳,其中常混有少量氯化氢气体,可通过盛有饱和碳酸氢钠溶液的F装置来除去,则混合气体应从F装置的_____端口(填“①”或“②”)通入,F中发生的化学方程式为_____。
(2)为了探究碱的性质,进行如图所示的实验。

①图甲所示,加入一定量的盐酸后,溶液由红色变为了无色,证明了盐酸和NaOH发生了中和反应,且反应后的溶液中一定没有的溶质是_____。张明对甲实验所得溶液的溶质成分产生了兴趣,对反应后溶液变为无色提出了以下两种猜想:
猜想1:溶质成分只有NaCl;
猜想2:溶质成分为_____。
(进行实验)为了验证自己的猜想正确,张明进行了如下实验,请你和他一起完成下列实验报告:
实验操作 | 实验现象 | 实验结论 |
取少量甲实验所得溶液于试管中,并往试管中加入_____ | 观察到_____ | 猜想2正确 |
②如图乙和丙所示,同时将两支充满CO2的相同试管分别倒扣在等体积的水和NaOH溶液中,一段时间后丙中试管内液面高于乙。说明NaOH与CO2发生了反应,该反应的化学方程式为_____。本实验中乙的作用是_____。
【题目】工业上用电解饱和食盐水的方法生产烧碱、氢气、氯气等化工产品,其反应原理为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。某研究性小组对制得的烧碱样品进行了如下探究:
2NaOH+H2↑+Cl2↑。某研究性小组对制得的烧碱样品进行了如下探究:
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)猜想一:样品露置在空气中导致样品可能含有碳酸钠。
猜想二:原料未完全转化导致样品可能含有氯化钠。
(实验探究)请帮甲同学完成以下探究实验:
猜想 | 实验步骤 | 实验现象 | 实验结论 |
猜想一 | ①取少量烧碱样品于试管中,加水溶解,向其中滴加过量稀硝酸 | 有气泡产生 | __________ |
②将步骤①中产生的气体通入澄清的石灰水中 | 澄清石灰水变浑浊 | ||
猜想二 | ③向步骤①所得的溶液中滴加几滴AgNO3溶液 | ________ | 样品中含有氯化钠 |
(解释与结论)乙同学为了验证猜想一的实验结论,也向烧碱样品的溶液中滴加了少量稀硝酸,却发现无气泡产生。大家经过分析,发现乙同学所用试剂与甲同学相同,却没有看到气泡。原因可能是_________。
(交流与反思)丙同学提出:“在甲同学做的实验中,稀硝酸也可以用稀盐酸代替。”你认为他观点_________(填“正确”或“不正确”)。