题目内容
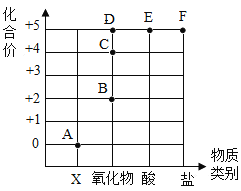
【题目】下图是a、b、c三种物质的溶解度曲线,下列分析不正确的是
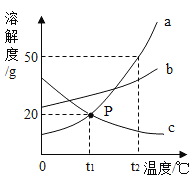
A.t2时a、b、c三种物质的溶质的质量分数由大到小的顺序是a>b>c
B.t2°C时,将50g a物质放入100g水中充分溶解得到a的饱和溶液 (a物质不含结晶水)
C.将t2°C时a、b、c三种物质的饱和溶液降温至t1°C时,所得溶液的溶质质量分数关系是b>a>c
D.a中含有少量c,要提纯a通常可采用冷却热饱和溶液的方法
【答案】A
【解析】
A、t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c,由于没有确定溶液的状态(是否饱和),所以不能确定溶液中溶质质量分数的大小,故A错误;
B、t2℃时,a的溶解度是50g,即100g水中溶解50g的a达到饱和状态,所以将50g a物质放入100g水中充分溶解得到a的饱和溶液,故B正确;
C、将t2℃时a、b、c三种物质的饱和溶液降温到t1℃时,a、b的溶解度减小,c的溶解度随温度的降低而增大,a、b有晶体析出,质量分数变小,溶液仍为饱和溶液,c没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=![]() ,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。,故C 正确;
,溶解度越大,质量分数越大,t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是b>a>c。,故C 正确;
D、a、b的溶解度都随温度的降低而减小,a的溶解度受温度影响较大,b的溶解度受温度影响较小,a中含有少量c,要提纯a通常可采用冷却热饱和溶液的方法,故D正确。故选A。

【题目】工业上用电解饱和食盐水的方法生产烧碱、氢气、氯气等化工产品,其反应原理为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。某研究性小组对制得的烧碱样品进行了如下探究:
2NaOH+H2↑+Cl2↑。某研究性小组对制得的烧碱样品进行了如下探究:
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)猜想一:样品露置在空气中导致样品可能含有碳酸钠。
猜想二:原料未完全转化导致样品可能含有氯化钠。
(实验探究)请帮甲同学完成以下探究实验:
猜想 | 实验步骤 | 实验现象 | 实验结论 |
猜想一 | ①取少量烧碱样品于试管中,加水溶解,向其中滴加过量稀硝酸 | 有气泡产生 | __________ |
②将步骤①中产生的气体通入澄清的石灰水中 | 澄清石灰水变浑浊 | ||
猜想二 | ③向步骤①所得的溶液中滴加几滴AgNO3溶液 | ________ | 样品中含有氯化钠 |
(解释与结论)乙同学为了验证猜想一的实验结论,也向烧碱样品的溶液中滴加了少量稀硝酸,却发现无气泡产生。大家经过分析,发现乙同学所用试剂与甲同学相同,却没有看到气泡。原因可能是_________。
(交流与反思)丙同学提出:“在甲同学做的实验中,稀硝酸也可以用稀盐酸代替。”你认为他观点_________(填“正确”或“不正确”)。