题目内容
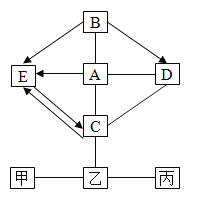
【题目】某校化学兴趣小组对1瓶溶液进行分析,初步确定它是含有同种阴离子的M、N混合液,继续分析的步骤如下(每一步骤都充分反应):
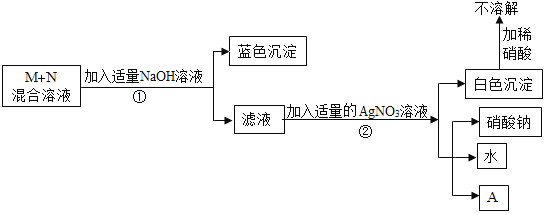
请根据过程及现象回答下列问题:
(1)若没有产物A,则M、N可能是____和______(写化学式);步骤①中发生反应的化学方程式是________;滤液中的溶质是(写化学式)_______.
(2)若有产物A,且A是一种常见的复合钾肥,则M、N可能是_____ 和 ______(写化学式).
【答案】NaCl CuCl2 CuCl2+2NaOH=Cu(OH)2↓+2NaCl NaCl KCl CuCl2
【解析】
(1)氯化银是不溶于酸的沉淀,滤液和硝酸银反应会生成不溶于硝酸的白色沉淀和硝酸钠,白色沉淀是氯化银,说明滤液中含有氯离子;氢氧化铜是蓝色沉淀,混合液中加氢氧化钠会生成蓝色沉淀,蓝色沉淀是氢氧化铜,说明混合液中存在铜离子;M、N含有同种阴离子的M、N混合液,所以可能是氯化钠和氯化铜;氯化铜和氢氧化钠反应生成氯化钠和氢氧化铜沉淀,化学方程式为:CuCl2+2NaOH═Cu(OH)2↓+2NaCl;如果氢氧化钠恰好与氯化铜完全反应,滤液中的溶质是氯化钠;故填:NaCl;CuCl2;CuCl2+2NaOH=Cu(OH)2↓+2NaCl;NaCl;
(2)产物A是一种复合钾肥,由于钾离子不能与其他离子发生复分解反应生成沉淀、气体或水,属于混合溶液中一定含有钾离子;滤液和硝酸银反应会生成不溶于硝酸的白色沉淀和硝酸钠,依据复分解反应原理可知,滤液中含有氯化钠,即混合溶液中含有氯离子;混合液中加氢氧化钠会生成蓝色沉淀,说明混合液中存在铜离子;M、N含有同种阴离子的M、N混合液,但是钠离子会进入滤液中,所以M和N混合物可能是氯化钾和氯化铜。故填:KCl;CuCl2。

 每日10分钟口算心算速算天天练系列答案
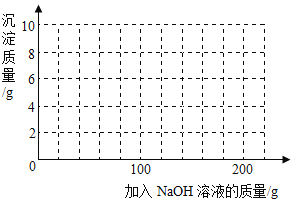
每日10分钟口算心算速算天天练系列答案【题目】现有H2SO4与CuSO4的混合溶液,为了分析混合溶液中H2SO4与CuSO4的质量分数,设计如下实验方案:取四份混合溶液各100 g,分别缓慢加入到50 g、100 g、150 g、200 g某NaOH溶液中,测得四组实验数据如下表:
第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
NaOH溶液的质量/g | 50 | 100 | 150 | 200 |
生成沉淀的质量/g | 0 | 2.45 | 7.35 | 9.8 |
(1)100 g混合溶液与NaOH溶液完全反应生成沉淀的质量为_______g。
(2)混合溶液中CuSO4的溶质质量分数是多少?(写出计算过程)
(3)混合溶液中H2SO4的溶质质量分数为___________。
(4)若在100 g混合溶液中不断加入上述NaOH的溶液,请画出加入NaOH溶液的质量与所产生沉淀质量的关系图。(在答题卡的坐标图中作图)