题目内容
【题目】氢化钙(CaH2)是有机合成的还原剂。遇水发生化学反应,生成氢氧化钙和氢气。为了测定某样品中氢化钙的含量,进行了如图所示实验,请计算:
(反应原理:CaH2 + 2H2O == Ca(OH)2 +2H2↑)
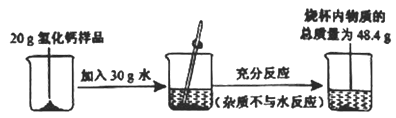
(1)生成氢气的质量是 g。
(2)该样品中氢化钙的质量分数(要求写出计算过程)。
【答案】(1)1.6g;(2)84%
【解析】(1)氢化钙(CaH2)遇水发生化学反应,生成氢氧化钙和氢气。氢气是气体会逸散到空气中,故烧杯中减少的质量即为生成的氢气的质量。生成氢气的质量=20g+30g-48.4g=1.6g;(2)利用化学方程式,根据氢化钙与氢气反应的质量比即可计算出氢化钙的质量。
设氢化钙的质量为x;
CaH2 + 2H2O == Ca(OH)2 +2H2↑
42 4
X 1.6g
![]() x=16.8g
x=16.8g
该样品中氢化钙的质量分数=![]() 84%
84%
答:生成氢气的质量为1.6g,该样品中氢化钙的质量分数为84% 。

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目