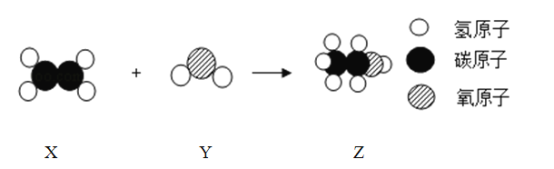
题目内容
【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”、“=”或“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_____(填实验序号),合理的结论是_____。
(交流探讨)MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
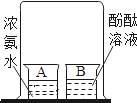
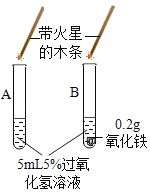
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
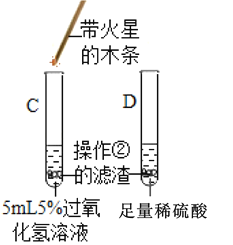
③ |
| C试管上方带火星的木条_____, D试管中溶液变成 _____色 | Fe2O3可作过氧化氢分解的催化剂 |
(得出结论)过氧化氢分解快慢受温度、浓度、催化剂等因素影响。
【答案】>③④其他条件相同时,H2O2溶液的溶质质量分数越高,过氧化氢分解越快加快称量复燃黄
【解析】
Ⅰ.(1)其他条件相同时,温度越高,过氧化氢分解越快,实验②温度较高,过氧化氢分解较快,因此 t2<t1;(2)要得出“过氧化氢分解快慢与溶质质量分数有关”的结论,需要其他条件相同,只有溶质质量分数不同的两组实验,即③④。比较③④两组实验可知,其他条件相同时,H2O2 溶液的溶质质量分数越高,过氧化氢分解越快。
Ⅱ.①B 组实验中加了氧化铁,反应速率比A组的快,由此能得出 Fe2O3 能加快过氧化氢分解。②由实验记录情况“固体质量0.2g”可知,该实验操作为称量。③Fe2O3 在氧化氢分解反应中做催化剂,催化剂在化学反应反应前后其化学性质并不发生改变,仍可以继续催化过氧化氢的分解,产生的氧气使带火星木条复燃; D 试管中进行的是氧化铁与稀硫酸的反应,化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,生成的Fe2(SO4)3为黄色溶液。

【题目】经过一年的化学学习,我们亲身体验了一系列的探究实验,感受了化学的无穷魅力.小强在回顾整理下列实验中提炼了许多探究的方法.
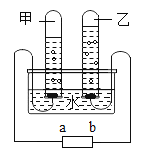
实验一、探究分子在不断运动(如图)
实验现象:________ .
该实验的探究方法是:对看不见、摸不着的粒子,要“观察”它的运动可以设计实验,通过宏观的现象来间接认识.
实验二、探究二氧化碳与水的反应(取四朵用紫色石蕊溶液染成紫色的干燥的小花,进行下图所示实验)

实验现象:(Ⅰ)、(Ⅳ)中的小花变红.
设计(Ⅱ)、(Ⅲ)实验的目的是:________ .
该实验的探究方法是:设计分析________ (填“A”或“B”或“C”),获得结论.
A.仅一个单因素的实验B.有多种因素的对比实验C.用前面实验的生成物继续实验
实验三、验证二氧化碳与氢氧化钠溶液确实发生了反应(实验如下表所示)
方案 | 实验步骤 | 实验现象 |
1 | 取两个等体积的软塑料瓶,充满二氧化碳,然后________ . | ________ |
2 | 先将二氧化碳通入盛有足量氢氧化钠溶液的试管 中,然后________ . | ________ |
我认为方案1的探究方法是________ ,方案2的探究方法是________ .
小结:上述三个实验告诉我们:当某些化学反应现象不明显或不足以说明问题时,要千方百计通过设计出具有明显现象的实验,来准确推知和认识化学反应.