题目内容
【题目】有CaCO3与CaO混合物20g 测得其中钙元素质量分数为60%.取该混合物,经高温煅烧充分反应后,将得到的固体投入足量的稀盐酸中,固体溶解全部生成CaCl2,则生成的CaCl2质量为( )
A. 11.lg B. 22.2g C. 44.4g D. 33.3g
【答案】D
【解析】
根据碳酸钙和氧化钙的质量和其中钙元素的质量分数可求其中钙元素的质量。反应过程中钙元素没有流失,全部转化。高温煅烧,碳酸钙变成氧化钙和二氧化碳,所有的氧化钙与盐酸反应得到氯化钙。故混合物中钙元素的质量等于生成的氯化钙中钙元素的质量。
混合物中钙元素质量为:20g×60%=12g;CaCl2中钙元素质量分数为:![]() ×100%;由于最终钙元素都转化为氯化钙的形式,所以生成的CaCl2质量为:12g÷(
×100%;由于最终钙元素都转化为氯化钙的形式,所以生成的CaCl2质量为:12g÷(![]() ×100%)=33.3g。故选D。
×100%)=33.3g。故选D。

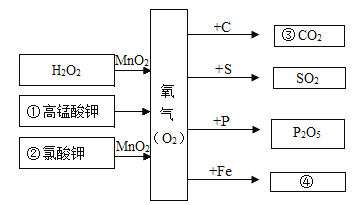
【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”、“=”或“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_____(填实验序号),合理的结论是_____。
(交流探讨)MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
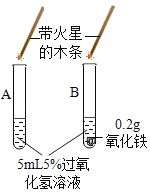
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
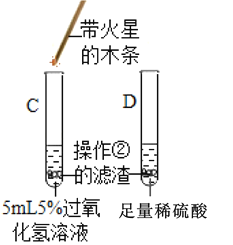
③ |
| C试管上方带火星的木条_____, D试管中溶液变成 _____色 | Fe2O3可作过氧化氢分解的催化剂 |
(得出结论)过氧化氢分解快慢受温度、浓度、催化剂等因素影响。
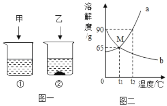
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤