题目内容
【题目】现有18.8g氯化钠和碳酸氢钠的固体混合物,将其放入烧杯中,再加入127g稀盐酸,恰好完全反应,反应后所得溶液的质量为137g。(温馨提示:化学反应方程式为NaHCO3+HCl=NaCl+H2O+CO2↑)请计算并回答下列问题:
(1)反应中生成气体的质量是多少_____?
(2)反应后所得溶液中溶质的质量分数是多少_____?
【答案】8.8g10%
【解析】
根据质量守恒定律,反应后减少的质量是生成二氧化碳的质量,然后根据化学方程式进行相关的计算。
(1)根据质量守恒定律,反应后减少的质量是生成二氧化碳的质量:18.8g+127g-137g=8.8g。(2)设固体混合物中碳酸钠的质量是x,生成氯化钠的质量是y。
NaHCO3+HCl=NaCl+H2O+CO2↑
84 58.5 44
x y 8.8g
![]() =
=![]() ,解得x=16.8g ,则混合物中氯化钠的质量为:18.8g-16.8g=2g
,解得x=16.8g ,则混合物中氯化钠的质量为:18.8g-16.8g=2g
![]() =
=![]() ,解得y=11.7g
,解得y=11.7g
反应后所得溶液中溶质的质量:2g+11.7g=13.7g
反应后所得溶液中溶质的质量分数是:![]() ×100%=10%
×100%=10%

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”、“=”或“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_____(填实验序号),合理的结论是_____。
(交流探讨)MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
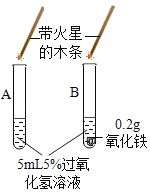
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
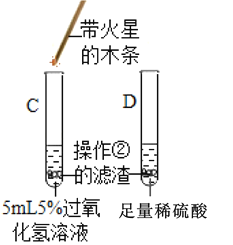
③ |
| C试管上方带火星的木条_____, D试管中溶液变成 _____色 | Fe2O3可作过氧化氢分解的催化剂 |
(得出结论)过氧化氢分解快慢受温度、浓度、催化剂等因素影响。
【题目】为测定某生理盐水的溶质质量分数,现象生理盐水样品与足量的硝酸银溶液混合,相关实验数据如表所示(不计损耗):
反应前 | 反应后 | ||
实验 数据 | 生理盐水样品的质量 | 加入硝酸银溶液的质量 | 过滤后剩余溶液的质量 |
130g | 40g | 167.13g |
①反应后生产氯化银固体的质量为 ________ g.
②请计算该生理盐水中含氯化钠的物质的量(根据化学方程式列式计算)________