题目内容
【题目】用“![]() ”和“
”和“![]() ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如下所示,下列说法正确的是
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如下所示,下列说法正确的是
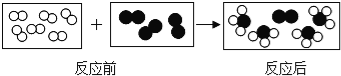
A. 该反应是化合反应
B. 该反应有2种生成物
C. 每个生成物分子由3个原子构成
D. 参加反应的“![]() ”和“
”和“![]() ”分子的个数比是2:1
”分子的个数比是2:1
【答案】A
【解析】
A、反应生成的四个分子构成相同,为同种物质的分子,即反应生成一种物质;反应物为两种单质;该反应为两种物质生成一种物质的化合反应;故A正确;
B、反应生成的四个分子构成相同,为同种物质的分子,而反应后的分子为未参加反应的分子、不是反应所生成的分子;因此反应的生成物只有一种;故B错误;
C、由反应的模拟模型图可得知,反应的生成物的分子由四个原子构成;故C不正确;
D、对比反应前后的分子,其中反应前的3个分子有1个未参加反应,因此,参加反应该分子有2个;图中的6个分子全部参加反应;所以,参加反应的“”和“”分子个数比为6:2=3:1;故D不正确.
故选A

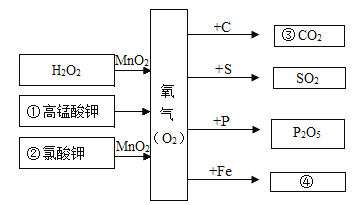
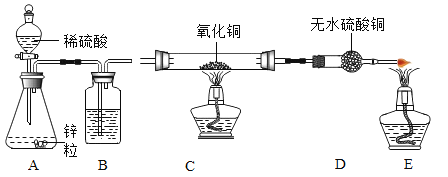
【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”、“=”或“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_____(填实验序号),合理的结论是_____。
(交流探讨)MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
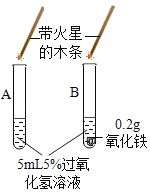
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
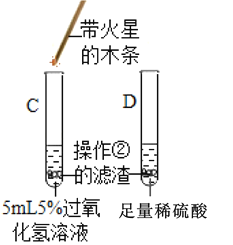
③ |
| C试管上方带火星的木条_____, D试管中溶液变成 _____色 | Fe2O3可作过氧化氢分解的催化剂 |
(得出结论)过氧化氢分解快慢受温度、浓度、催化剂等因素影响。
【题目】硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解 度/g | Li2SO4 | 36.1 | 35.4 | 34.8 | 34.3 | 33.9 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | |
请回答下列问题:

(1)依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是_______(填“甲”或“乙”)。
(2)Li2SO4和KNO3在某一温度时具有相同的溶解度x,则x的范围是_________________。
(3)40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是________________。
(4)将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数__________(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。
(5)如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是______(填字母序号)。
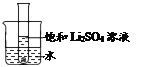
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A.②④ B.①③⑤ C.③④ D.①②⑤
【题目】为测定某生理盐水的溶质质量分数,现象生理盐水样品与足量的硝酸银溶液混合,相关实验数据如表所示(不计损耗):
反应前 | 反应后 | ||
实验 数据 | 生理盐水样品的质量 | 加入硝酸银溶液的质量 | 过滤后剩余溶液的质量 |
130g | 40g | 167.13g |
①反应后生产氯化银固体的质量为 ________ g.
②请计算该生理盐水中含氯化钠的物质的量(根据化学方程式列式计算)________