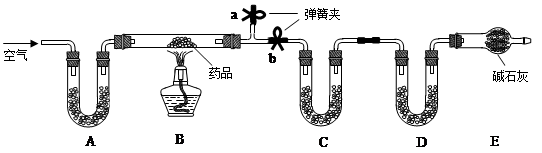
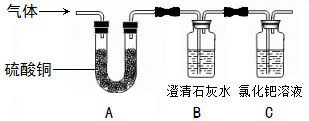
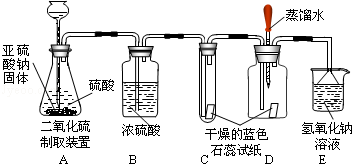
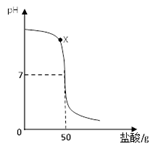
题目内容
某兴趣小组同学在实验室将一定量的稀硫酸加入到盛有氢氧化钠溶液的烧杯中,未看到明显的现象.部分同学产生疑问:酸和碱到底能否发生反应?
(1)该小组同学又做了如下实验:
| 实验步骤 | 实验现象 | 实验结论及反应方程式 |
| 向滴有酚酞溶液的稀氢氧化钠溶液的试管中,加入稀硫酸,并振荡 | 观察到溶液由 色变为无色. | 氢氧化钠和硫酸发生了反应.反应的化学方程式为 . |
(2)同学们对(1)实验后溶液中的溶质组成展开探究,做出如下猜想:
小明的猜想是:只有Na2SO4;
小亮的猜想是:有Na2SO4和NaOH;
小丽的猜想是:有Na2SO4和H2SO4;
你认为 的猜想不合理.理由是 .
若要验证余下两种猜想中的一种是正确的,请完成下面的实验方案.
| 实验步骤 | 预期实验现象 | 实验结论 |
| 取(1)实验后溶液少量于试管中,加入 | | 的猜想正确 |
(1)实验步骤 实验现象 实验结论及反应方程式 向滴有酚酞溶液的稀氢氧化钠溶液的试管中,加入稀硫酸,并振荡 观察到溶液由 红
色变为无色.氢氧化钠和硫酸发生了反应.反应的化学方程式为
H2SO4+2NaOH═Na2SO4+2H2O.
(2)小亮;如果有NaOH存在,含有酚酞的溶液不能为无色;实验步骤 预期实验现象 实验结论 锌粒 有气泡产生
(或没有气泡产生)小丽
(或小明)
解析试题分析:(1)氢氧化钠溶液能够使酚酞变红,所以在加入稀硫酸之前溶液呈红色,当加入稀硫酸,由于氢氧化钠和稀硫酸反应生成了硫酸钠和水,而硫酸为中性的溶液,所以可以观察到溶液的红色消失,该反应的化学方程式为:H2SO4+2NaOH═Na2SO4+2H2O;
(2)溶液变为了无色,说明不含有氢氧化钠,故可以判断小亮的猜想是错误的,而要验证小明和小丽的猜想只需验证是否含有硫酸即可,根据硫酸的性质,可以选择活泼的金属来进行验证,例如锌,如果观察到有气泡冒出,则说明溶液中含有硫酸,反之则没有硫酸
考点:中和反应及其应用;书写化学方程式、文字表达式、电离方程式.
点评:在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全.

(10分)在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)
进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的探究。
Ⅰ.定性探究:
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是 ,
②是CaCl2.
【收集资料】CaCl2水溶液呈中性。
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加 | | 猜想①正确。碳酸钠与其反应的化学方程式为 |
探究二过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH 和Na2CO3 ;
猜想二: ;
猜想三:NaOH 。
(3)【实验验证】同学们经过交流讨论,设计以下实验方案确定滤液中溶质的组成:
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液, B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| | “猜想二”成立 | |
| | “猜想三”成立 |
Ⅱ.定量探究:
【提出问题】过滤后澄清滤液中NaOH的质量分数是多少?
【设计实验】
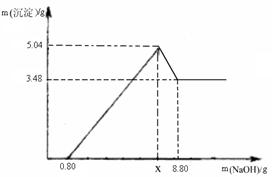
小明同学取100g过滤后澄清滤液于烧杯中,向烧杯中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示:计算过滤后澄清滤液中NaOH的质量分数是多少?(请列出计算过程)
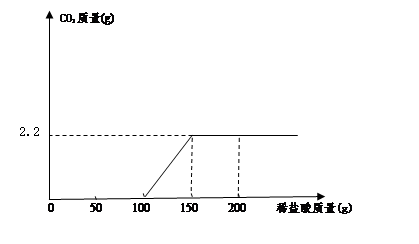
已知粉末X是下列四种物质中的一种,取三等份该粉末,分别加入到足量的碳酸钠溶液、硝酸银溶液、稀盐酸中并振荡,产生的现象如下表.则该固体粉末X是
| 加入物质 | 碳酸钠溶液 | 硝酸银溶液 | 稀盐酸 |
| 现 象 | 产生白色沉淀 | 产生白色沉淀 | 固体溶解 |