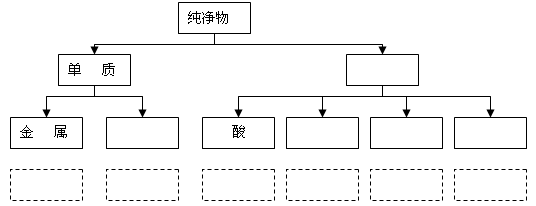
题目内容
已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)16CO3·4H2O,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应。某研究性学习小组设计了如下实验探究铝碳酸镁片的组成。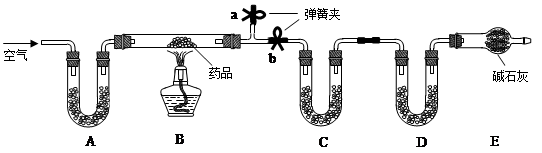
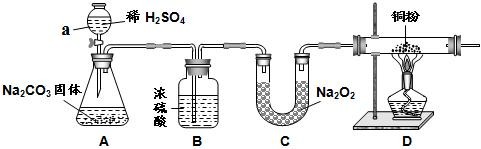
【实验一】取m g该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g。
(1)铝碳酸镁片加热分解的产物为Al2O3、MgO、CO2和水,则为分别测定CO2和水的质量,装置C和D中盛放的药品应选择:C D (填序号)。
①浓硫酸 ②碱石灰 ③氯化钙 ④纯碱
(2)实验开始前先通入一定量空气,其操作方法是关闭弹簧夹 ,打开弹簧夹 ,目的是 。
(3)一段时间后,打开弹簧夹 ,关闭弹簧夹 ,点燃酒精灯加热,充分反应后,停止加热,继续通入空气至玻璃管冷却的目的是 (填序号)。
①排净空气防爆炸
②防止空气中水和二氧化碳进入C、D影响测定
③使生成水和二氧化碳进入C、D被充分吸收
【实验二】另取m g该药片,加入100 g 9.8%的稀硫酸,充分反应后滤去不溶物,得到含有MgSO4和Al2(SO4)3等溶质的滤液,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。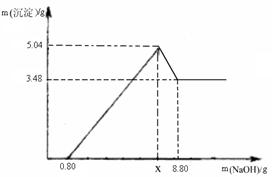
已知:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
Al(OH)3+NaOH=NaAlO2+2H2O,
Mg(OH)2不溶于NaOH, NaAlO2可溶于水。
(1)图中NaOH加入0.80g,仍没有沉淀,说明滤液中含 。当加入NaOH的质量到x时,生成的沉淀有 和 ,其中Al(OH)3的质量是 g,则x= g。
(2)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是 。
(3)试确定铝碳酸镁的化学式为 。
【实验一】(1)③ ②
(2)b a 排尽装置内空气,防止干扰
(3)b a ③
【实验二】(1)稀硫酸 Al(OH)3 Mg(OH)2 1.56 4
(2)该药在使用过程中会产生气体,严重胃溃疡的患者服用会产生胃穿孔
(3)Al2Mg6(OH)16CO3·4H2O
解析试题分析:【实验一】(1)C中应装的是固体干燥剂所以选③,D中药品作用是吸收二氧化碳,所以选②。
(2)验开始前先通入一定量空气,其操作方法是关闭弹簧夹b,然后打开a ,将多余的空气排出,防止空气对实验形成干扰。
(3)一段时间后,打开弹簧夹空气排尽后应关闭a ,打开b ,继续通入空气至玻璃管冷却的目的是使生成水和二氧化碳进入C、D被充分吸收。
【实验二】(1)图中NaOH加入0.80g,仍没有沉淀,说明滤液中含稀硫酸,NaOH先和稀硫酸反应,没有产生沉淀,后来才与MgSO4,Al2(SO4)3反应生成Al(OH)3 和 Mg(OH)2。由题意知道Al(OH)3还能和NaOH反应,所以图中沉淀质量会减少,减少的质量即为Al(OH)3 的质量,5.04 – 3.48 = 1.56g,最后剩余的沉淀即为Mg(OH)2沉淀,为3.48g。在0.8到x这段发生的反应为MgSO4+2NaOH = Mg(OH)2 ↓+ Na2SO4 Al2(SO4)3 + 6NaOH = 2Al(OH)3 ↓+3 Na2SO4,根据生成的Mg(OH)2和Al(OH)3的质量可以求出NaOH的总质量为7.2g,则x为0.8+7.2 = 8g。
(2)该药在使用过程中会产生气体,严重胃溃疡的患者服用会产生胃穿孔
(3)由(1)可求出物质中镁元素与铝元素的质量比为48:9 =" 24b" :27a ,则a:b=1:3,再根据正负化合价代数和为0,可求出此物质的化学式为Al2Mg6(OH)16CO3·4H2O
考点:探究实验的研究,气体流程试题的解决方法,根据题目信息进行化学计算等。

实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。
(1)根据受损标签的情况判断,这瓶试剂不可能是
A.酸 B.碱 C.盐
(2) 已知 Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.室温(20℃)时,四种物质的溶解度的数据如下图:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
根据试剂瓶标注的溶质质量分数10%和右表中的溶解度的数据判断,这瓶试剂不可能是 。
(3) 用pH试纸上测得该溶液的pH>7,这瓶试剂不可能是 。
(4) 为了确定该溶液是哪种溶液,现进行如下进一步的实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加 | 产生大量的气泡 | 该溶液是 ,反应的化学方程式 |
(6) 为了探究一瓶氯化钙溶液的质量分数,取该溶液50g,加入50g碳酸钾溶液,恰好完全反
应,所得溶液质量95g,计算此氯化钙溶液的质量分数。
同学们运用对比的学习方法探究碱的性质。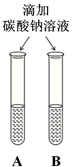
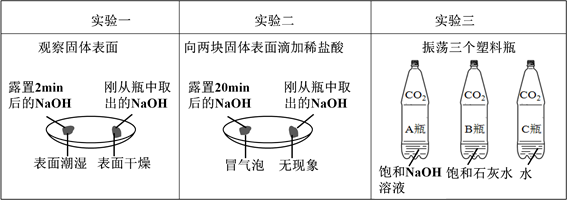
(1)由上图实验一、二可知,氢氧化钠会吸收空气的 ,因此要密封保存。
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C, A瓶内发生反应的化学方程式为 ,对比A瓶与 (选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应。
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙溶液(分别编号为A、B)。
| 方案一 | 方案二 | 分析 |
| 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,A中试剂为 ; 方案二的设计原理是利用了 。 |
(4)同学们看到盛有NaOH的试剂瓶上标注着“NaOH含量不少于96.0%”,开始如下探究:
【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是:2NaCl + 2H2O
 2NaOH + H2↑ + Cl2↑,
2NaOH + H2↑ + Cl2↑,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】杂质为碳酸钠和氯化钠。
【实验探究】取样溶于水,并分成两份。
步骤①:向一份溶液中滴加酚酞试剂;
步骤②:向另一份溶液中滴加过量稀硝酸;
步骤③:向②所得溶液中继续滴加硝酸银溶液。
【实验结论】猜想正确。
请分析:
Ⅰ.步骤①中可观察到液体变 色;
Ⅱ.步骤②所得溶液中的溶质除NaCl外,还有 ;
Ⅲ.写出步骤③中发生反应的化学方程式 ;
Ⅳ.上述实验中步骤 (填写序号)是没有必要进行的。
实验课上,张影同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)余承骏同学却说:“这种无色溶液中不一定含有氢氧化钠。”他做了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 无色溶液中含有氢氧化钠 |
宋楷认为余承骏的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是: 。
(2)宋楷设计了另一个实验:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入足量的CaCl2溶液 ②过滤,向滤液中滴加几滴硫酸铜溶液 | ③ ④有蓝色沉淀生成 | 无色溶液中确实含有氢氧化钠 |
(3)宋楷的实验可靠性高的原因是 。
某兴趣小组同学在实验室将一定量的稀硫酸加入到盛有氢氧化钠溶液的烧杯中,未看到明显的现象.部分同学产生疑问:酸和碱到底能否发生反应?
(1)该小组同学又做了如下实验:
| 实验步骤 | 实验现象 | 实验结论及反应方程式 |
| 向滴有酚酞溶液的稀氢氧化钠溶液的试管中,加入稀硫酸,并振荡 | 观察到溶液由 色变为无色. | 氢氧化钠和硫酸发生了反应.反应的化学方程式为 . |
(2)同学们对(1)实验后溶液中的溶质组成展开探究,做出如下猜想:
小明的猜想是:只有Na2SO4;
小亮的猜想是:有Na2SO4和NaOH;
小丽的猜想是:有Na2SO4和H2SO4;
你认为 的猜想不合理.理由是 .
若要验证余下两种猜想中的一种是正确的,请完成下面的实验方案.
| 实验步骤 | 预期实验现象 | 实验结论 |
| 取(1)实验后溶液少量于试管中,加入 | | 的猜想正确 |