题目内容
【题目】我国拥有丰富的海洋资源,海洋中蕴藏着丰富的化学资源。
(1)蒸馏法淡化海水是利用海水中各成份的_____不同分离出淡水;海水晒盐属于混合物分离操作中的是_____(填序号)。
A 蒸馏 B 蒸发 C 过滤 D 沉淀
(2)粗盐中含有泥沙、氯化钙、氯化镁等杂质。将粗盐溶于水,先加入过量的NaOH溶液,目的是除去粗盐中_____;再加入过量的Na2CO3溶液,目的是除去粗盐中_____;过滤,向滤液中加入适量的盐酸,再将滤液蒸发结晶,即可得到较纯的氯化钠。
(3)南海油气资源丰富,石油加工可得到液化石油气,假设某液化石油气的主要成分为C3H8,写出其完全燃烧的化学方程式_____。
【答案】沸点 B 氯化镁 氯化钙 C3H8+5O2![]() 3CO2+4H2O
3CO2+4H2O
【解析】
氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,氯化钙和碳酸钠反应生成碳酸钙和氯化钠。
(1)蒸馏法淡化海水是利用海水中各成份的沸点不同分离出淡水;海水中含有水、氯化钠、氯化镁等物质属于混合物,海水晒盐主要是通过阳光和风力使水分蒸发,使晶体结晶析出的过程,故选B。
(2)氯化镁和氢氧化钠反应生成氢氧化镁和氯化钠,将粗盐溶于水,先加入过量的NaOH溶液,目的是除去粗盐中氯化镁;氯化钙和碳酸钠反应生成碳酸钙和氯化钠,故再加入过量的Na2CO3溶液,目的是除去粗盐中氯化钙。
(3)某液化石油气的主要成分为C3H8,完全燃烧生成二氧化碳和水,反应的化学方程式为C3H8+5O2![]() 3CO2+4H2O。
3CO2+4H2O。

【题目】某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性学习小组对该厂生产的烧碱样品进行如下探究。
2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性学习小组对该厂生产的烧碱样品进行如下探究。
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)
猜想1:可能含有Na2CO3;
猜想2:可能含有NaCl;
猜想3:可能含有_____。
作出猜想1的依据是_____ (用化学方程式表示)。
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
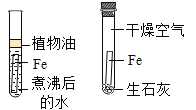
I、取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁。 | 试管外壁发热 | 原因是_____。 |
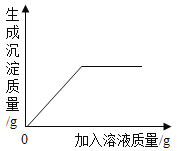
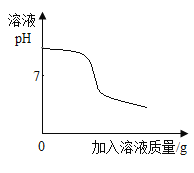
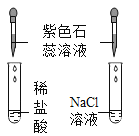
II、向I所得的溶液中逐滴加入 稀硝酸至过量 | 刚开始_____,一段时间后产生能使澄清石灰水变浑浊的气体。 | 猜想1可能成立。 |
III、向II所得的溶液中_____。 | 产生白色沉淀 | 结合实验II,猜想3成立。 |
(交流与讨论)
小坚同学提出:“上述实验II中稀硝酸也可以用稀盐酸代替”。你认为他的观点_____(填“正确”或“不正确”),理由是_____。