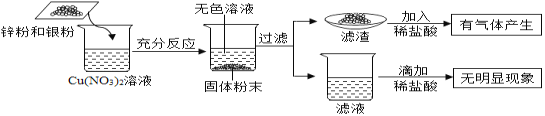
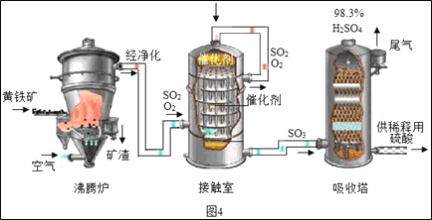
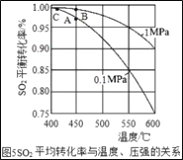
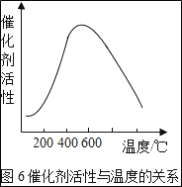
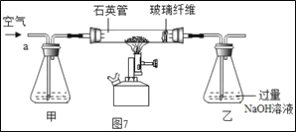
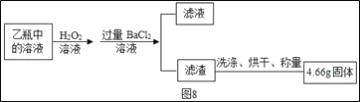
��Ŀ����
����Ŀ��NH4Cl��Na2SO4���ܽ�ȱ����ܽ���������¡�����˵����ȷ����
�¶�/�� | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ�� S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
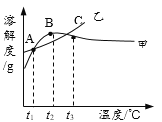
A. ��ΪNH4Cl
B. t3��Ӧ����30����40��
C. �����ʵı�����Һ��t2���µ�t3����Һ������������������
D. �ס��ұ�����Һ��t3���µ�t1���������壨�������ᾧˮ��������һ�����
���𰸡�C
��������
A��ͨ�������ܽ�ȱ��е����ݿ�֪���Ȼ�淋��ܽ�����¶ȵ����߶�����������Ϊ�Ȼ�泥���ѡ�����
B������NH4Cl��Na2SO4���ܽ�ȱ����ס����ܽ�ȵڶ������ʱ��Ӧ���¶���40��-50�棬�����ܽ�����ߣ��ס����ܽ�ȵڶ������ʱ��Ӧ���¶�С��t3�棬��t3Ӧ����40�棬��ѡ�����
C�������ʵı�����Һ��t2���µ�t3���ܽ���������������壬��Һ�����������������䣬��ѡ����ȷ��
D����Ϊû��ָ����Һ���������ס��ұ�����Һ��t3���µ�t1�����ľ���������һ����ȣ���ѡ�����ѡC��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�����Ŀ��̼�ᱵ�㷺Ӧ��������ܡ��մɡ���ѧ��������ҵ����һ��̼���ο�ʯ����Ҫ�ɷ�Ϊ̼�ᱵ��̼��ƣ��Դ˿�ʯΪԭ������̼�ᱵ��������ͼ��ʾ��
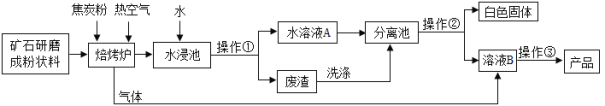
���������ϣ�
I��̼�ᱵ��̼��ƾ������ƵĻ�ѧ���ʣ��������������ƶ�����ˮ��Ӧ���ɶ�Ӧ�ļ������������������̼��Ӧ��
���±���ʾ�������ּ��ڲ�ͬ�¶��µ��ܽ��
�¶�/�� | 0 | 40 | 80 |
Ca(OH)2�ܽ�ȣ�g | 0.187 | 0.141 | 0.094 |
Ba(OH)2�ܽ�ȣ�g | 1.67 | 8.22 | 101.4 |
��1��д��ˮ��������������ˮ��Ӧ�Ļ�ѧ����ʽ____________��
��2���������˵����ȷ����________��
a����¯�����ӽ�̿�ۺ��ȿ�����Ϊ��ά��¯�ڷ�Ӧ����ĸ���״̬��
b����¯��ֻ�漰�ֽⷴӦ��
c������Ҫ����ϴ�Ӳ�����������Ϊ�˱���������ͬʱΪ����߲��ʣ�
d�ù������̿��Լ���CO2������ŷţ���������ЧӦ��
��3������ˮ֮�⣬���������е�������_________�������ڵIJ�����________��ѡ�� �������������������������ˡ�
��4��д������ҺB��ȡ��Ʒ̼�ᱵ�Ļ�ѧ����ʽ��__________��
����Ŀ������һ����ɫ��ĩ��������NH4Cl��Na2CO3��NaHCO3�е�һ�ֻ�����ɡ�СӨΪ��̽����ɷ֣�����������ʵ�飺
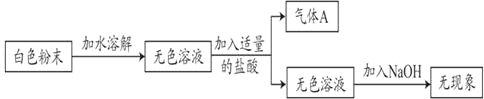
��1��������ʵ���֪����A��_____��
��2������������ʵ������ԭ��ɫ��ĩһ��û��_____��
��3�����������⣩Na2CO3��NaHCO3�����ᷴӦ�����ܲ������壬��ȷ������ijɷ֡�
���������ϣ�
��NaHCO3������Եĸ��Ρ����λ��û�г���������
��NaHCO3��������Ca��OH��2��Ӧ�а�ɫ����������
��������룩
����1����ɫ��ĩֻ��_____��
����2����ɫ��ĩֻ��Na2CO3��
����3����ɫ��ĩ��_____��
��ʵ��̽����
С��Ϊ����֤����룬ȡ�����İ�ɫ��ĩ�����ձ��У���ˮȫ���ܽ����������Ca��OH��2��Һ��������_____��������Ϊ�������ȷ��С����ΪС�µĽ��۲���ȷ��������_____��
���������˽�һ����̽����
ʵ����� | ���� | ʵ����� |
ȡ��ɫ��ĩ���ձ��У���ˮ�ܽ⣬�ټ���BaCl2��Һ��ֽ��裬���� | ����_____���� | ����_____���� |
��_____ | ֤����ɫ����϶���_____��������_____ | |
ȡ10.6g��ɫ��ĩ����ƿ�У���������ϡ���������ɵ�����ͨ��������NaOH��Һ�У���Ӧ��ȫ��Ƶ�NaOH��Һ����4.5g | ȷ�ϲ���_____���� |