题目内容
【题目】为了探究金属和盐溶液的反应规律,将一定质量的锌粉和银粉加入到硝酸铜溶液中,充分反应,实验过程及实验现象如下图所示,则下列说法中正确的是
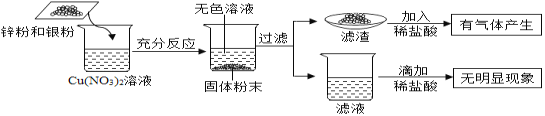
A. 滤渣中可能含单质锌B. 滤渣中一定含有Cu、Ag、Zn
C. 滤液中一定含有Zn2+和Ag+D. 充分反应后溶液质量减少
【答案】B
【解析】
金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,将一定质量的锌粉和银粉加入到硝酸铜溶液中,则锌粉与硝酸铜溶液反应,Zn+Cu(NO3)2= Zn(NO3)2 + Cu,如果充分反应后,得到无色溶液,则硝酸铜完全参加反应无剩余。
A. 向滤渣中加入稀盐酸,有气体产生,则滤渣中含有锌,此选项错误;
B. 滤渣中一定含有生成的Cu、没参加反应的Ag、过量的Zn,此选项正确;
C. 滤液中的溶质是Zn(NO3)2,所以一定含有Zn2+,银没有参与反应,无Ag+,此选项错误;
D. 将一定质量的锌粉和银粉加入到硝酸铜溶液中,则锌粉与硝酸铜溶液反应,Zn+Cu(NO3)2= Zn(NO3)2 + Cu,充分反应后,固体质量减少,则溶液质量增多,此选项错误。故选B。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
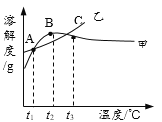
A. 甲为NH4Cl
B. t3℃应介于30℃~40℃
C. 乙物质的饱和溶液从t2升温到t3,溶液的溶质质量分数不变
D. 甲、乙饱和溶液从t3降温到t1,析出晶体(均不带结晶水)的质量一定相等