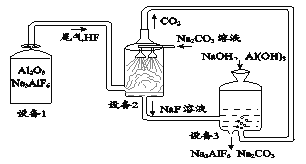
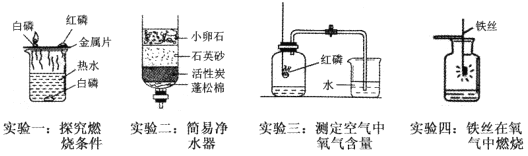
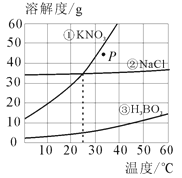
ЬтФПФкШн
ЁОЬтФПЁПЯжгавЛАќАзЩЋЗлФЉЃЌПЩФмгЩNH4ClЁЂNa2CO3ЁЂNaHCO3жаЕФвЛжжЛђМИжжзщГЩЁЃаЁгЈЮЊСЫЬНОПЦфГЩЗжЃЌНјааСЫШчЯТЪЕбщЃК
ЃЈ1ЃЉгЩЩЯЪіЪЕбщПЩжЊЦјЬхAЪЧ_____ЁЃ
ЃЈ2ЃЉИљОнЩЯЪіЕФЪЕбщЯжЯѓЃЌдАзЩЋЗлФЉвЛЖЈУЛга_____ЁЃ
ЃЈ3ЃЉЃЈЗЂЯжЮЪЬтЃЉNa2CO3ЁЂNaHCO3гыбЮЫсЗДгІЃЌОљФмВњЩњЦјЬхЃЌЮоЗЈШЗЖЈЙЬЬхЕФГЩЗжЁЃ
ЃЈВщдФзЪСЯЃЉ
ЂйNaHCO3гыПЩШмадЕФИЦбЮЁЂБЕбЮЛьКЯУЛгаГСЕэВњЩњЁЃ
ЂкNaHCO3гызуСПЕФCaЃЈOHЃЉ2ЗДгІгаАзЩЋГСЕэВњЩњЁЃ
ЃЈЬсГіВТЯыЃЉ
ВТЯы1ЃКАзЩЋЗлФЉжЛга_____ЃЛ
ВТЯы2ЃКАзЩЋЗлФЉжЛгаNa2CO3ЃЛ
ВТЯы3ЃКАзЩЋЗлФЉЪЧ_____ЁЃ
ЃЈЪЕбщЬНОПЃЉ
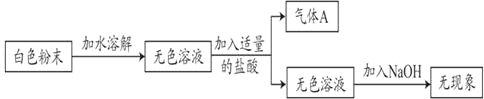
аЁгТЮЊСЫбщжЄЦфВТЯыЃЌШЁЩйСПЕФАзЩЋЗлФЉЗХШыЩеБжаЃЌМгЫЎШЋВПШмНтКѓЃЌМгШызуСПЕФCaЃЈOHЃЉ2ШмвКЃЌЯжЯѓЪЧ_____ЃЌЫћОЭШЯЮЊВТЯыЖўе§ШЗЁЃаЁНмШЯЮЊаЁгТЕФНсТлВЛе§ШЗЃЌРэгЩЪЧ_____ЃЌ
гкЪЧЫћзіСЫНјвЛВНЕФЬНОПЃК
ЪЕбщВйзї | ЯжЯѓ | ЪЕбщНсТл |
ШЁАзЩЋЗлФЉгкЩеБжаЃЌМгЫЎШмНтЃЌдйМгШыBaCl2ШмвКГфЗжНСАшЃЌОВжУ | ШєЮо_____ЯжЯѓ | ВТЯы_____ГЩСЂ |
Шє_____ | жЄУїАзЩЋЙЬЬхПЯЖЈга_____ЃЌПЩФмга_____ | |
ШЁ10.6gАзЩЋЗлФЉгкзЖаЮЦПжаЃЌМгШызуСПЯЁбЮЫсКѓАбЩњГЩЕФЦјЬхЭЈШызуСПЕФNaOHШмвКжаЃЌЗДгІЭъШЋКѓГЦЕУNaOHШмвКдіжи4.5g | ШЗШЯВТЯы_____ГЩСЂ |
ЁОД№АИЁПЖўбѕЛЏЬМ ТШЛЏяЇ NaHCO3 NaHCO3ЁЂNa2CO3 ВњЩњАзЩЋГСЕэ NaHCO3гызуСПЕФCaЃЈOHЃЉ2ЗДгІвВгаАзЩЋГСЕэВњЩњ ГСЕэВњЩњ 1 ВњЩњАзЩЋГСЕэ Na2CO3 NaHCO3 3
ЁОНтЮіЁП
ЃЈ1ЃЉгЩЩЯЪіЪЕбщПЩжЊЦјЬхAЪЧбЮЫсКЭЬМЫсФЦЛђЬМЫсЧтФЦЗДгІЩњГЩЕФЖўбѕЛЏЬМЁЃ
ЙЪЬюЃКЖўбѕЛЏЬМЁЃ
ЃЈ2ЃЉИљОнЩЯЪіЕФЪЕбщЯжЯѓПЩжЊЃЌЮоЩЋШмвКжаМгШыЧтбѕЛЏФЦЮоУїЯдЯжЯѓЃЌЫЕУїдАзЩЋЗлФЉвЛЖЈУЛгаТШЛЏяЇЁЃ
ЙЪЬюЃКТШЛЏяЇЁЃ
ЃЈ3ЃЉ[ЬсГіВТЯы]
ВТЯы1ЃКАзЩЋЗлФЉжЛгаNaHCO3ЃЛ
ВТЯы2ЃКАзЩЋЗлФЉжЛгаNa2CO3ЃЛ
ВТЯы3ЃКАзЩЋЗлФЉЪЧNaHCO3ЁЂNa2CO3ЁЃ
ЙЪЬюЃКNaHCO3ЃЛNaHCO3ЁЂNa2CO3ЁЃ
[ЪЕбщЬНОП]
ШЁЩйСПЕФАзЩЋЗлФЉЗХШыЩеБжаЃЌМгЫЎШЋВПШмНтКѓЃЌМгШызуСПЕФCaЃЈOHЃЉ2ШмвКЃЌВњЩњАзЩЋГСЕэЃЌОЭШЯЮЊВТЯыЖўе§ШЗЃЌаЁНмШЯЮЊаЁгТЕФНсТлВЛе§ШЗЃЌРэгЩЃКNaHCO3гызуСПЕФCaЃЈOHЃЉ2ЗДгІвВгаАзЩЋГСЕэВњЩњЁЃ
ЙЪЬюЃКВњЩњАзЩЋГСЕэЃЛNaHCO3гызуСПЕФCaЃЈOHЃЉ2ЗДгІвВгаАзЩЋГСЕэВњЩњЁЃ
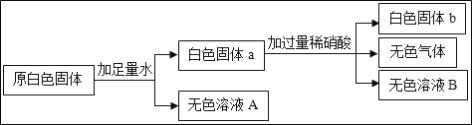
НјвЛВНЕФЬНОПЃКШЁАзЩЋЗлФЉгкЩеБжаЃЌМгЫЎШмНтЃЌдйМгШыBaCl2ШмвКГфЗжНСАшЃЌОВжУЃЌШчЙћВЛВњЩњГСЕэЃЌЫЕУїАзЩЋЙЬЬхЪЧЬМЫсЧтФЦЃЌШчЙћВњЩњАзЩЋГСЕэЃЌЪЧвђЮЊТШЛЏБЕКЭЬМЫсФЦЗДгІЩњГЩАзЩЋГСЕэЬМЫсБЕКЭТШЛЏФЦЃЌжЄУїАзЩЋЙЬЬхПЯЖЈгаЬМЫсФЦЃЛ
ШчЙћАзЩЋЗлФЉЪЧЬМЫсФЦЪБЃЌ10.6gЬМЫсФЦКЭбЮЫсЗДгІЩњГЩЕФЖўбѕЛЏЬМжЪСПЪЧ4.4gЃЌЖјЗДгІЭъШЋКѓГЦЕУNaOHШмвКдіжи4.5gЃЌЫЕУїАзЩЋЗлФЉЪЧЬМЫсФЦКЭЬМЫсЧтФЦЕФЛьКЯЮяЃЌЪЕбщЙ§ГЬШчЯТЫљЪОЃК
ЪЕбщВйзї | ЯжЯѓ | ЪЕбщНсТл |
ШЁАзЩЋЗлФЉгкЩеБжаЃЌМгЫЎШмНтЃЌдйМгШыBaCl2ШмвКГфЗжНСАшЃЌОВжУ | ШєЮоГСЕэВњЩњЯжЯѓ | ВТЯы1ГЩСЂ |
ШєВњЩњАзЩЋГСЕэ | жЄУїАзЩЋЙЬЬхПЯЖЈКЌгаNa2CO3ЃЌПЩФмгаNaHCO3 | |
ШЁ10.6gАзЩЋЗлФЉгкзЖаЮЦПжаЃЌМгШызуСПЯЁбЮЫсКѓАбЩњГЩЕФЦјЬхЭЈШызуСПЕФNaOHШмвКжаЃЌЗДгІЭъШЋКѓГЦЕУNaOHШмвКдіжи4.5g | ШЗШЯВТЯы3ГЩСЂ |

 ЛЊЖЋЪІДѓАцвЛПЮвЛСЗЯЕСаД№АИ
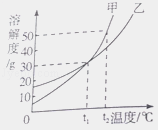
ЛЊЖЋЪІДѓАцвЛПЮвЛСЗЯЕСаД№АИЁОЬтФПЁПNH4ClКЭNa2SO4ЕФШмНтЖШБэМАШмНтЖШЧњЯпШчЯТЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
ЮТЖШ/Ёц | 10 | 20 | 30 | 40 | 50 | 60 | |
ШмНтЖШ S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
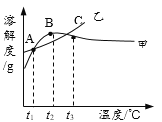
A. МзЮЊNH4Cl
B. t3ЁцгІНщгк30ЁцЁЋ40Ёц
C. ввЮяжЪЕФБЅКЭШмвКДгt2Щ§ЮТЕНt3ЃЌШмвКЕФШмжЪжЪСПЗжЪ§ВЛБф
D. МзЁЂввБЅКЭШмвКДгt3НЕЮТЕНt1ЃЌЮіГіОЇЬхЃЈОљВЛДјНсОЇЫЎЃЉЕФжЪСПвЛЖЈЯрЕШ