题目内容
【题目】“高质发展,后发先至”是连云港新一轮发展的主线,我市濒临黄海,拥有丰富的海洋资源。
(1)食用海鱼、海虾等海鲜可为人体提供的营养素主要是_____(填序号)
A 糖类 B 蛋白质 C 维生素 D 油脂
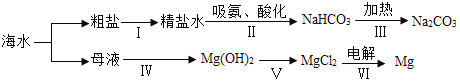
(2)从海水中获得粗盐的方法是采用蒸发结晶,而不是降温结晶,理由是_____;
(3)用氯化钠固体配制 100g 质量分数为 10%的氯化钠溶液。若测得所配制溶液的溶质质量分数偏小,其 原因可能是_____(填序号)。
A 氯化钠固体不纯 B 量取水时,俯视读数
C 溶解时,烧杯内壁有水 D 装瓶时,有少量溶液洒出
(4)某浓度的海水中主要离子的浓度如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO 42﹣ |
浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
①从海水中提取 MgCl2,将 MgCl2 溶液在一定条件下蒸发结晶、熔融电解可制得金属镁,则 2L 该浓度的 海水理论上可得到金属镁的质量为_____g;
②将一定量的镁粉加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后过滤,得到滤液和滤渣。取少 量滤液,加入稀盐酸溶液,无明显现象,则滤液中一定没有_____;取少量滤渣,加入足量稀盐酸, 有气泡产生,则滤渣中一定含有_____;
③净化水常用的方法有沉降、过滤、吸附和蒸馏,活性炭在净水器中能起到过滤和吸附的作用,这是由于 活性炭具有_____结构。
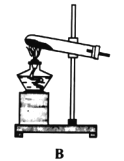
④电解水实验揭示了水的组成(如下图)。
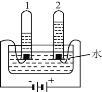
电解水的反应方程式为__________________, 实验过程中可加入稀硫酸以增强导电性,实验结束后,溶液 pH 将_______(填“增大”、 “减小”或“不变”)。
(5)常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得。
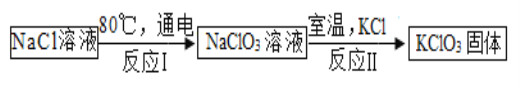
①实验室用氯酸钾制取氧气的化学方程式为_____ ;
②反应Ⅰ中,是将_____能转化成化学能;
③反应Ⅱ的基本反应类型为复分解反应,请写出反应方程式_____;
④该工业转化中可以循环利用的物质是_____ 。
【答案】B 氯化钠的溶解度受温度变化影响较小 AC 57.6 硝酸银 铁 疏松多孔 2H2O![]() 2H2↑+O2↑ 减少
2H2↑+O2↑ 减少 ![]() 电
电 ![]() 氯化钠
氯化钠
【解析】
(1)食用海鱼、海虾等海鲜可为人体提供的营养素主要是蛋白质,故选B;
(2)氯化钠的溶解度受温度变化影响较小,所以从海水中获得粗盐的方法是采用蒸发结晶,而不是降温结晶;
(3)测得所配制溶液的溶质质量分数偏小,可能是溶质质量偏小或溶剂质量偏大。
A 氯化钠固体不纯,氯化钠的实际质量偏小,导致所配制溶液的溶质质量分数偏小,故A正确;
B 量取水时,俯视读数,水的实际体积偏小,导致所配制溶液的溶质质量分数偏大,故B错误;
C 溶解时,烧杯内壁有水,导致所配制溶液的溶质质量分数偏小,故C正确;
D 溶液具有均一性。装瓶时,有少量溶液洒出,不会影响氯化钠的质量分数,故D错误。故选AC;
(4)①依据镁元素守恒可知,每升海水中含有镁离子的质量是28.8g,所以2L该浓度的海水理论上可得到金属镁的质量为57.6g;
②将一定量的镁粉加入到适量硝酸亚铁和硝酸银的混合溶液中,镁会先与硝酸银反应,再与硝酸亚铁反应,所以取少量滤液,加入稀盐酸溶液,无明显现象,则滤液中一定没有硝酸银;取少量滤渣,加入足量稀盐酸,有气泡产生,则滤渣中一定含有铁;
③活性炭具有疏松多孔的结构,具有吸附性;
④水在通电的条件下生成氢气和氧气,化学方程式为:2H2O![]() 2H2↑+O2↑,水的质量减小,稀硫酸的浓度增大,所以溶液pH将减小;
2H2↑+O2↑,水的质量减小,稀硫酸的浓度增大,所以溶液pH将减小;
(5)①氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,![]() ;
;
②反应Ⅰ中,是将电能转化成化学能;
③反应Ⅱ,即氯酸钠溶液与氯化钾反应生成氯酸钾固体和氯化钠,化学方程式为:NaClO3+KCl═KClO3↓+NaCl;
④氯化钠在反应过程中,既是反应物,也是生成物,该转化中可以循环利用的物质是氯化钠(NaCl)。