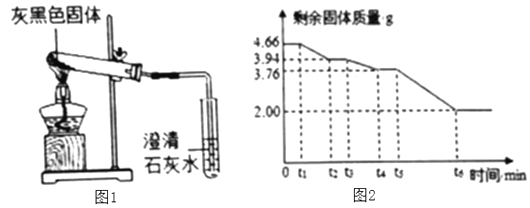
题目内容
【题目】海洋中蕴含着丰富的资源,人们可以从海水中获取很多物质。
(1)海水淡化是解决淡水资源不足的重要方法。下列方法中,可以使海水淡化的是_____ (填字母序号)。
A 过滤法 B 沉淀法 C 多级闪急蒸馏法 D 分解法
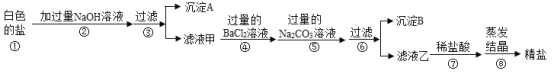
(2)海水蒸发结晶可制得粗盐。晒制粗盐的主要成分为NaCl,还含有少量的MgCl2;、CaCl2、MgSO4、泥沙等杂质。下面是由粗盐获取较纯净精盐的一种方法:
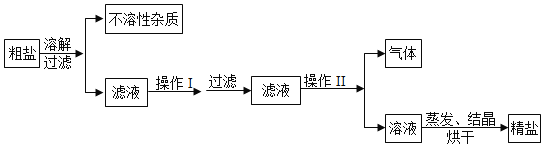
①为除去MgCl2、CaCl2、MgSO4可溶性杂质,操作I中依次加入的物质(过量)和顺序,合理的是_____;
a NaOH、BaCl2、Na2CO3; b Ba(NO3)2、Na2CO3、NaOH
c Na2CO3、BaCl2、NaOH d BaCl2、NaOH、Na2CO3
②操作I过量加入各物质的目的是_____;
③操作Ⅱ加入适量的盐酸,作用是_____。
④假设除杂过程中氯化钠没有损失,则理论上除杂后获得食盐的质量_____除杂前食盐的质量(填“>”“<”或“=”)
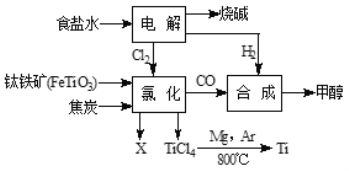
(3)利用海水制取纯碱和金属镁的流程如图所示,试回答问题:
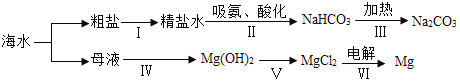
①在步骤Ⅱ中通入氨气的作用是_____,请写出步骤ⅲ中发生反应的化学方程式_____。
②提取氯化镁经历ⅳ、ⅴ两步转换的目的是_____。写出步骤ⅳ中发生反应的化学方程式_____。
【答案】c ad 使欲除去的物质完全反应 除杂过程中又生成氯化钠 > 使溶液显碱性,更易吸收二氧化碳 2NaHCO3![]() Na2CO3+H2O+CO2↑ 为了获得比较纯净的氯化 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
Na2CO3+H2O+CO2↑ 为了获得比较纯净的氯化 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
【解析】
(1)A 过滤不能除去海水中的离子,因此不能淡化海水,故A错误;
B 沉淀能够除去不溶于水的固体,不能除去海水中的离子,因此不能淡化海水,故B错误;
C 多级闪急蒸馏是把水从水的混合物中分离出来,得到纯净的水,能淡化海水,故C正确;
D 分解法是把水分解成氢气和氧气,不能达到净水的目的,故D错误。故选C。
(2)①a 加入氢氧化钠可以除去氯化镁和硫酸镁,加入氯化钡可以除去反应生成的硫酸钠,加入碳酸钠可以产生氯化钙和过量的氯化钡,故a正确;
b 加入硝酸钡可以除去硫酸镁,但是带入新的杂质硝酸镁,带入的硝酸根离子无法除去,故b错误;
c 加入碳酸钠可以除去氯化钙,加入氯化钡可以产生硫酸镁,但是过量的氯化钡无法除去,故c错误;
d 加入氯化钡可以除去硫酸镁,加入氢氧化镁可以除去氯化镁,加入碳酸钠可以除去氯化钙和过量的氯化钡,故d正确。故选ad;
②操作I过量加入各物质的目的是使欲除去的物质完全反应;
③盐酸能与过量的氢氧化钠和碳酸钠反应,生成氯化钠,操作Ⅱ加入适量盐酸的作用是除杂过程中又生成氯化钠;
④假设除杂过程中氯化钠没有损失,则理论上除杂后获得食盐的质量大于除杂前食盐的质量,其理由是除杂过程中又生成氯化钠;
(3)①步骤Ⅱ中通入氨气的作用是氨气溶于水形成氨水,氨水显碱性,从而使溶液显碱性,所以在步骤②中通入氨气的作用是:使溶液显碱性,更易吸收二氧化碳;
由步骤ⅲ中碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
②海水提镁中氯化镁能与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,步骤ⅳ中发生反应的化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,提取氯化镁历经ⅳ、ⅴ两步转换是为了获得比较纯净的氯化镁。

【题目】下列化学方程式与对应反应类型均正确的是( )
化学方程式 | 反应类型 | |
A | H2O | 分解反应 |
B | 4Al+3O2=2Al2O3 | 化合反应 |
C | 2Fe+6HCl═2FeCl3 +3H2↑ | 置换反应 |
D | CO2 +2NaOH ═Na2CO3+H2O | 复分解反应 |
A. AB. BC. CD. D
【题目】“高质发展,后发先至”是连云港新一轮发展的主线,我市濒临黄海,拥有丰富的海洋资源。
(1)食用海鱼、海虾等海鲜可为人体提供的营养素主要是_____(填序号)
A 糖类 B 蛋白质 C 维生素 D 油脂
(2)从海水中获得粗盐的方法是采用蒸发结晶,而不是降温结晶,理由是_____;
(3)用氯化钠固体配制 100g 质量分数为 10%的氯化钠溶液。若测得所配制溶液的溶质质量分数偏小,其 原因可能是_____(填序号)。
A 氯化钠固体不纯 B 量取水时,俯视读数
C 溶解时,烧杯内壁有水 D 装瓶时,有少量溶液洒出
(4)某浓度的海水中主要离子的浓度如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO 42﹣ |
浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
①从海水中提取 MgCl2,将 MgCl2 溶液在一定条件下蒸发结晶、熔融电解可制得金属镁,则 2L 该浓度的 海水理论上可得到金属镁的质量为_____g;
②将一定量的镁粉加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后过滤,得到滤液和滤渣。取少 量滤液,加入稀盐酸溶液,无明显现象,则滤液中一定没有_____;取少量滤渣,加入足量稀盐酸, 有气泡产生,则滤渣中一定含有_____;
③净化水常用的方法有沉降、过滤、吸附和蒸馏,活性炭在净水器中能起到过滤和吸附的作用,这是由于 活性炭具有_____结构。
④电解水实验揭示了水的组成(如下图)。
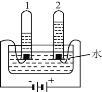
电解水的反应方程式为__________________, 实验过程中可加入稀硫酸以增强导电性,实验结束后,溶液 pH 将_______(填“增大”、 “减小”或“不变”)。
(5)常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得。
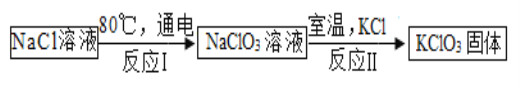
①实验室用氯酸钾制取氧气的化学方程式为_____ ;
②反应Ⅰ中,是将_____能转化成化学能;
③反应Ⅱ的基本反应类型为复分解反应,请写出反应方程式_____;
④该工业转化中可以循环利用的物质是_____ 。
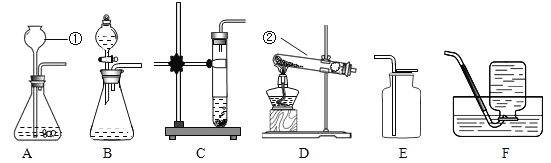
【题目】下列实验操作能够达到实验目的是
序号 | 实验目的 | 主要操作 |
A | 鉴别加碘食盐和无碘食盐 | 各取少量样品,加入淀粉溶液,观察 |
B | 检验 | 将气体通入紫色石蕊试液,观察 |
C | 除 | 加入稀盐酸,充分溶解后,过滤 |
D | 除去氯化钠固体中的少量碳酸钠 | 加入适量稀盐酸,充分反应后,蒸发 |
A. AB. BC. CD. D