��Ŀ����
����Ŀ��ʵ���ҿ����գ�ij��ѧ��ȤС���ͬѧ����ʦ��ָ���£����������ʵ��װ�ý���������ȡ��̽�����ش����⣺


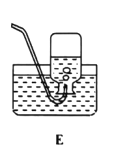
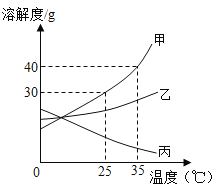
��1��ʵ�������������ȡ�����ķ���װ����_____������ţ����÷�Ӧ�Ļ�ѧ����ʽΪ_____.
��2��ѡ�������ռ�����ʱ�����뿼�ǵ�����������_____������ţ���
����ɫ ���ܶ� ���ܽ��� �ܿ�ȼ��
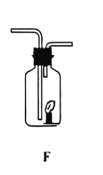
��3��ijͬѧ����A��F����ʵ�飬A������ҩƷ��ͬ��
����ʵ��ʱF���������Ϩ����A�з�Ӧ�Ļ�ѧ����ʽΪ_____
����ʵ��ʱF������ȼ�ո�������A�з�Ӧ�Ļ�ѧ����ʽΪ_____
���𰸡�B ![]() �ڢ� CaCO3+2HCl=CaCl2+H2O+CO2��
�ڢ� CaCO3+2HCl=CaCl2+H2O+CO2�� ![]()
��������
ʵ������ȡ���巢��װ�õ�ѡ����Ҫ����Ӧ���״̬����̬����Һ̬���ͷ�Ӧ�������Ƿ���Ҫ���ȣ���������װ�÷�Ϊ���������װ�ú�Һ��ϲ�������װ�ã��ռ�װ����Ҫ��������������ˮ�е��ܽ����Լ��Ƿ��ˮ��Ӧ�����ܷ�����ˮ������������ˮ������ˮ�Ҳ���ˮ������Ӧ���Բ�����ˮ���ռ��������Ը�������Ϳ����ܶȵıȽ��Լ��Ƿ�Ϳ����еĸ��ɷַ�Ӧ���ж��ܷ�����ſ������ռ�����������ܶȺͿ����ܶȷdz��ӽ������˲����ſ���������ʹ���ſ������ռ�ʱ���ܶȱȿ�����IJ��������ſ��������ܶȱȿ���С�IJ��������ſ������ռ���
��1��ʵ�������������ȡ��������Ӧ���ǹ��壬��Ӧ�����Ǽ��ȣ�����װ��Ӧѡ���������װ�ã�����B��������ڶ������̵Ĵ��ͼ��������·ֽ������Ȼ��غ���������ѧ����ʽ���![]() ��
��
��2�����Ϸ�����֪����������ܶȺ��ܽ���ѡ�������ռ����������뿼�ǵ��������ʹ���ڢۣ�
��3��
�ٸ����������Ϩ��˵�����ɵ����岻��ȼ����ȼ�������ռ������dz����̳�˵���ܶȱȿ��������ж����ɵ������Ƕ�����̼��A�з�Ӧ�Ļ�ѧ����ʽ���CaCO3+2HCl=CaCl2+H2O+CO2����
����ʵ��ʱF������ȼ�ո�����˵�����ɵ���������������A�з�Ӧ�Ļ�ѧ����ʽ���![]() ��
��

 һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�����Ŀ�����������ڹ����������ճ������еõ��ձ�㷺��Ӧ��
��1������ͼ��ʾʵ��̽���������������ÿ֧�Թ��о�������ȫ��ͬ�Ľྻ��Ƭ����
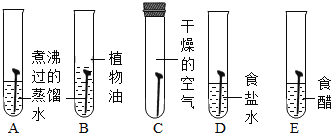
����ͬѧ��Ϊ���Թ�A������������ܹ�˵��������ʴ����������е�������ˮ������ͬ���õĽ������ͬѧ��ͬ�����Ĺ۵㣬��Ϊ����ȫ��۲��Թ�_______��ѡ���Թܱ�ţ�����������������ѧ�Ͻ������������ܵó��������ۡ�B��ֲ���͵�������_______��
���Թ�D��Eʵ���Ŀ���ǽ�һ��̽������_______�Ļ������Ƿ��������ʴ��
��2����ͭ��ͭп�Ͻ��������ǵ����졣����һ��ʹ�ù��ģ��⼣�߰ߵĵ��ǣ������������ǿ����Ƶ�����п��ͭ������Ҫ������ͼ����ʾ��
���ռ����ϣ������ϵ�����ҪΪCu2��OH��2CO3������ϡ���ᷴӦ�õ�����ͭ��Һ���������������ʲ�����ˮ��Ҳ���μӷ�Ӧ��
�� ��
��д�������ϵ�����ϡ���ᷴӦ�Ļ�ѧ����ʽ_______��
������DΪ_______�����۵ĽǶ�������A��E�ķ�Ӧ��ʵ����_______��
��3��Ϊ�˱Ƚϼס������ֽ����Ļ��ǿ�������ԭ��������С��С������һ��ʵ��װ�ã���ͼ�ң�����ȡ���ֽ�����m�ˣ��ֱ����������ϡ������з�Ӧ������ͬ�����²ⶨ��ͬʱ�����ռ��������������ʵ���¼�����
��Ӧʱ�䣨�룩 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
�ռ�������������������� | ���� | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
�ҽ��� | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
����ʵ������֪��������Խ�ǿ����_______��ʵ���У�����Ҫ�������ֽ�����������ȣ�����Ҫ���Ƶı�����_______��
��Ϊ��ʹ�õ���ʵ������ȷ��С껿�ʼ�ռ������ʱ���Ӧ����_______������ĸ��
A.���ܿ�һ������ð��ʱ B.ð�����������Ҿ���ʱC.������������崿��ʱ
����������ʵ�����ݣ�Ҫ�Ƚϼס������ֽ��������ԭ��������С������֪����������______��
����Ŀ�����л�ѧ����ʽ���Ӧ��Ӧ���;���ȷ���ǣ�������
��ѧ����ʽ | ��Ӧ���� | |
A | H2O | �ֽⷴӦ |
B | 4Al+3O2��2Al2O3 | ���Ϸ�Ӧ |
C | 2Fe+6HCl�T2FeCl3 +3H2�� | �û���Ӧ |
D | CO2 +2NaOH �TNa2CO3+H2O | ���ֽⷴӦ |
A. AB. BC. CD. D
����Ŀ�������ʷ�չ���������������Ƹ���һ�ַ�չ�����ߣ����б��ٻƺ���ӵ�зḻ�ĺ�����Դ��
��1��ʳ�ú��㡢��Ϻ�Ⱥ��ʿ�Ϊ�����ṩ��Ӫ������Ҫ��_____������ţ�
A ���� B ������ C ά���� D ��֬
��2���Ӻ�ˮ�л�ô��εķ����Dz��������ᾧ�������ǽ��½ᾧ��������_____��
��3�����Ȼ��ƹ������� 100g ��������Ϊ 10%���Ȼ�����Һ���������������Һ��������������ƫС���� ԭ�������_____������ţ���
A �Ȼ��ƹ��岻�� B ��ȡˮʱ�����Ӷ���
C �ܽ�ʱ���ձ��ڱ���ˮ D װƿʱ����������Һ����
��4��ijŨ�ȵĺ�ˮ����Ҫ���ӵ�Ũ�����£�
���� | Na+ | Mg2+ | Cl�� | SO 42�� |
Ũ��/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
�ٴӺ�ˮ����ȡ MgCl2���� MgCl2 ��Һ��һ�������������ᾧ�����ڵ����Ƶý���þ���� 2L ��Ũ�ȵ� ��ˮ�����Ͽɵõ�����þ������Ϊ_____g��
�ڽ�һ������þ�ۼ��뵽���������������������Ļ����Һ�У���ַ�Ӧ����ˣ��õ���Һ��������ȡ�� ����Һ������ϡ������Һ����������������Һ��һ��û��_____��ȡ������������������ϡ���ᣬ �����ݲ�������������һ������_____��
�۾���ˮ���õķ����г��������ˡ�������������̿�ھ�ˮ���������˺����������ã��������� ����̿����_____�ṹ��
�ܵ��ˮʵ���ʾ��ˮ����ɣ�����ͼ����
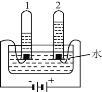
���ˮ�ķ�Ӧ����ʽΪ__________________�� ʵ������пɼ���ϡ��������ǿ�����ԣ�ʵ���������Һ pH ��_______�������������� ����С����������������
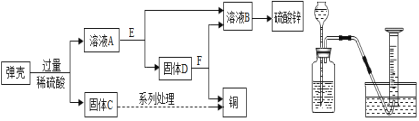
��5�������£�����ص��ܽ�Ƚ�С���ڹ�ҵ�Ͽ�ͨ������ת���Ƶá�
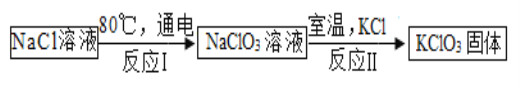
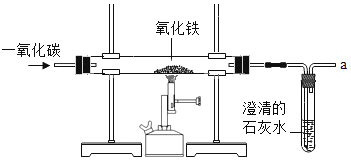
��ʵ�������������ȡ�����Ļ�ѧ����ʽΪ_____ ��
�ڷ�Ӧ���У��ǽ�_____��ת���ɻ�ѧ�ܣ�
�۷�Ӧ��Ļ�����Ӧ����Ϊ���ֽⷴӦ����д����Ӧ����ʽ_____��
�ܸù�ҵת���п���ѭ�����õ�������_____ ��