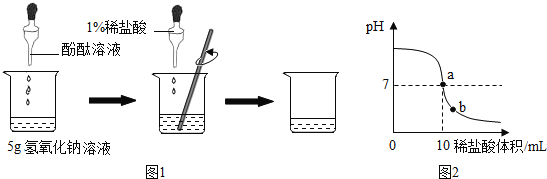
题目内容
【题目】钠的化合物在日常生活中有着广泛的应用。
(1)若将100g 9%的氯化钠溶液稀释为0.9%的氯化钠溶液,需要加入水的质量为____g。
(2)过氧化钠(Na2O2)和CO2反应,可以生成纯碱和氧气,所以可作为呼吸面具和潜水艇的供氧剂,请写出该反应的化学方程式:_______。
(3)《四川盐法志》记载,“敞锅熬盐”主要步骤为:①将黄卤和黑卤按比例混合;②放入敞口锅中加热浓缩,析出粗盐;③用“花水”冲洗粗盐得精品盐。请回答,步骤①中,黄卤所含杂质BaCl2和黑卤所含杂质MgSO4反应生成白色沉淀,该反应的化学方程式为________。步骤②中,析出粗盐的过程称为_______。步骤③用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl.则“花水”应当是_____(填标号)
A蒸馏水 B饱和 NaCl溶液 C饱和NaOH溶液 D饱和BaCl2溶液
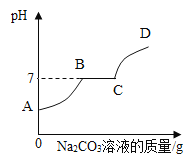
(4)某同学对实验室制取CO2后的剩余液体进行探究。首先向废液中滴加少量紫色石蕊试液,然后再逐滴加入Na2CO3溶液,溶液pH的变化如图所示。BC段的现象是______。向C点所示溶液中加入硝酸银溶液,发生反应的化学方程式________。
(5)食用纯碱中常含有少量的氯化钠。现取某食用纯碱样品10g,加入一定量的稀盐酸恰好完全反应,同时生成了3.3g气体。试计算该食用纯碱中Na2CO3的质量分数。_____
【答案】900 ![]()
![]() 蒸发结晶 B 溶液变为紫色,有白色沉淀生成
蒸发结晶 B 溶液变为紫色,有白色沉淀生成 ![]() 79.5%
79.5%
【解析】
(1)设加入水的质量为m。则:100g×9%=(100g+m)×0.9%,解得m=900g;
(2)过氧化钠(Na2O2)和CO2反应,可以生成纯碱和氧气,反应的化学方程式是:![]() ;
;
(3)氯化钡和硫酸镁反应生成硫酸钡沉淀和氯化镁,化学方程式为:![]() ;食盐的溶解度受温度变化影响较小,所以步骤②中,析出粗盐的过程称为:蒸发结晶;
;食盐的溶解度受温度变化影响较小,所以步骤②中,析出粗盐的过程称为:蒸发结晶;
用“花水冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl,由此可知:
A、氯化钠能溶于蒸馏水,蒸馏水会造成氯化钠的减少,故A错误;
B、饱和NaCl溶液会溶解氯化镁和氯化钡,不能溶解氯化钠,不会造成氯化钠的减少,故B正确;
C、饱和NaOH溶液会溶解氯化钠,损失NaCl,故C错误;
D、饱和BaCl2溶液会溶解氯化钠,损失NaCl,故D错误。故选B。
(4)某同学对实验室制取CO2后的剩余液体进行探究首先向废液中滴加少量紫色石蕊试液,然后再逐滴加入Na2CO3溶液。由溶液pH的变化可知,开始时溶液显酸性,加入紫色石蕊试液应显红色,然后加入的碳酸钠先与稀盐酸反应,当稀盐酸反应完全后,溶液显中性,然后与氯化钙反应。所以BC段的现象是溶液变为紫色,有白色沉淀生成;C点所示溶液中含有氯化钠,加入硝酸银溶液,氯化钠与硝酸银反应生成氯化银沉淀和硝酸钠,反应的化学方程式为:![]() ;
;
(5)设碳酸钠的质量为x
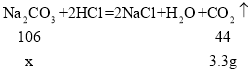
![]()
x=7.95g
食用纯碱中Na2CO3的质量分数=![]() 。
。
答:样品中的Na2CO3的质量分数为79.5%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案