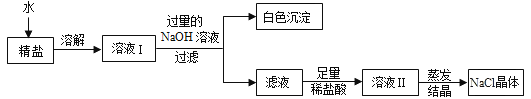
题目内容
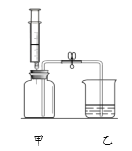
【题目】实验室的废液M中可能含有![]() 中的一种或几种,为确定其成分进行实验。
中的一种或几种,为确定其成分进行实验。
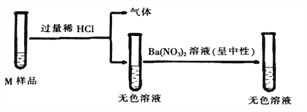
(1)图中生成气体的化学反应方程式为_________;
(2)废液M中一定没有___________;
(3)为进一步确定M的成分,又进行如下实验:
Ⅰ 重新取M样品,滴加过量的试剂X静置;
Ⅱ 取Ⅰ中的上层清液,滴加酚酞溶液;
Ⅲ 向Ⅱ中的溶液滴加过量的稀硝酸;
Ⅳ 向Ⅲ中的溶液滴加试剂Y。
分析以上实验过程,回答问题:
①试剂X是_______(选填“![]() ”或“
”或“![]() ”)溶液,试剂Y是______溶液;
”)溶液,试剂Y是______溶液;
②能确定M中含有NaOH的现象是_______;
③能确定M中含有NaCl的化学反应方程式为___________。
【答案】 Na2CO3 +2HCl==2NaCl+H2O+CO2↑ Na2SO4 Ba(NO3)2 AgNO3 向Ⅰ中的上层清液里滴加酚酞,溶液变红色 NaCl+AgNO3==AgCl↓+NaNO3
【解析】根据所学知识和题中信息知,碳酸钠与盐酸反应生成二氧化碳气体,故有碳酸钠。(1)图中生成气体的化学反应方程式为Na2CO3 +2HCl==2NaCl+H2O+CO2↑。 (2)加入硝酸钡后得到无色溶液,废液M中一定没有Na2SO4,盐酸过量,硝酸钡与硫酸钠反应生成不溶于酸的白色沉淀,故没有硫酸钠。(3) ①试剂X是Ba(NO3)2 溶液,与碳酸钠反应生成碳酸钡白色沉淀。试剂Y是AgNO3,硝酸银溶液与氯化钠溶液反应生成氯化银白色沉淀。②能确定M中含有NaOH的现象是向Ⅰ中的上层清液里滴加酚酞,溶液变红色,酚酞遇碱性溶液变红。③能确定M中含有NaCl的化学反应方程式为NaCl+AgNO3=AgCl↓+NaNO3。
点睛∶碳酸钠与盐酸反应生成二氧化碳气体,这是我们检验碳酸盐常用的方法。酚酞遇碱性溶液变红。

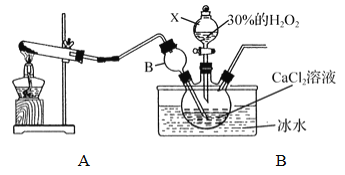
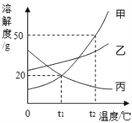
【题目】化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。各小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。

A组:探究催化剂对化学反应速率的影响;
取5mL10%H2O2溶液,三次实验分别加人0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此得出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用。
(1)你认为该结论是否正确,为什么?_________________________________________。
(2)经过补充对比实验,证明红砖粉末有催化作用,则三者的催化效率由高到低的顺序为___________。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,,进行实验,记录时间t1。
(3)乙同学:取10mL2.5%H2O2溶液,加入__________为催化剂,进行实验,记录时间t2。
实验结果:_______________________________________________________
结论:___________________________________________________________
【拓展探究】
(4)C组:探究____________对化学反应速率的影响。
各取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴,记录时间t3、t4。
(5)实验结果:_________________________;
结论:当反应物浓度和催化剂相同时,__________________________________。
(6)以上三组实验说明,影响化学反应速率的因素有:________________________。
【题目】化学小组的同学用下图所示装置进行如下实验,实验前K1、K2、K3均为关闭状态。
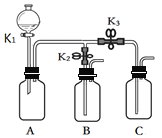
内容 步骤 | 实验步骤 |
实验1 | B、C中分别盛有无色酚酞试液,打开K1,从分液漏斗中加入浓氨水,关闭K1,然后打开K2、K3。 |
实验2 | A中盛满CO2,B中盛有氢氧化钙溶液,C中盛有稀盐酸。 ①打开K1,从分液漏斗慢慢放入适量的氢氧化钠溶液,关闭K1。 ②一段时间后打开K2,观察到有A中有沉淀产生时,迅速关闭K2。 ③再打开K3,观察到A中有气泡产生。 |
(1)实验1中,可以观察到的现象是__________。
(2)实验2中,步骤①中所发生反应的化学方程式为____________________。
(3)实验2中,请解释步骤③产生气泡的原因为____________________。