题目内容
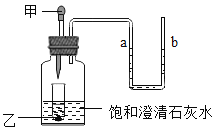
【题目】下图是实验室制备气体的常用装置和仪器。
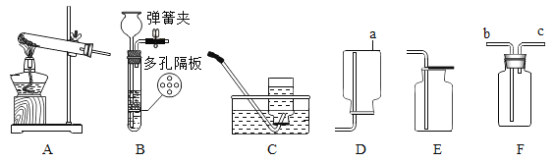
Ⅰ:(1)写出图中标号仪器的名称:a_____
(2)实验室用A装置制取氧气,写出反应的化学方程式_____;实验操作时,组装好仪器后,应先_____,再添加药品;若选择装置C收集满氧气后,应先用玻璃片_____(选填“磨砂”或“光滑”)的一面盖住集气瓶口,再移出水槽正放在桌面上
(3)实验室可用锌粒与稀硫酸反应制取H2,写出该反应的化学方程式_____,若用装置B制氢气,该装置的优点是_____。若用装置F排空气法收集氢气,气体应从_____端进入(填b或c)
Ⅱ:小亮和小华两位同学在实验室用块状大理石和5%的稀盐酸反应制取CO2,观察不到气泡产生时,发现固体还有剩余,对此进行探究(杂质不溶水且不与酸反应)。
(提出问题)不再产生气泡的原因是什么?
(猜想假设)猜想一:盐酸己经完全反应
猜想二:剩余固体中无碳酸钙
猜想三:生成物或杂质附着在大理石表面,阻碍反应继续进行
(实验探究1)反应后溶液中是否有盐酸。
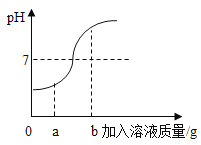
(1)小亮取上述反应后的溶液,用pH试纸测得溶液pH=2,说明溶液显_____性,由此得出猜想一不成立的结论。
(2)小华认为此结论不够严谨,还应考虑生成物对溶液酸碱度的影响,补充了如下实验。
①取洁净的烧杯,另配制_____溶液,测得溶液pH=7。
②取洁净的试管,加入适量水和紫色石蕊溶液,持续通入CO2,发现溶液变为_____色。但小亮认为实验②不能说明CO2对溶液酸碱度的影响,他重新改进了实验:另取洁净的试管,加入适量水,持续通入CO2至饱和,测得溶液pH=5.9。
由以上实验可知:该反应的生成物对溶液酸碱度影响不大,猜想一不成立,反应后的溶液中有盐酸。
(实验探究2)剩余固体中是否有碳酸钙。
小亮先振荡反应容器,使剩余固体和液体充分接触,观察到仍无气泡产生。再向容器中滴加少量5%的稀盐酸,又有气泡产生。一段时间后,不再产生气泡,仍有固体剩余。产生气泡的化学方程式是_____。
由以上实验可知,猜想二和猜想三不成立。
(得出结论)根据以上实验探究,可得出影响反应是否进行的因素之一是_____。
(反思交流)小华又提出,也可能是反应太慢,无法观察到气泡产生。她设计了如下对比实验:
取出(实验探究2)所得的部分清液,放置一段时间后,测得pH为X,同时测得(实验探究2)容器中剩余溶液的pH为Y,若X_____Y(填“>”“=”“<”),则她的猜想成立。
【答案】集气瓶 2KClO3![]() 2KCl+3O2↑ 检查装置气密性 磨砂 Zn+H2SO4=ZnSO4+H2↑ 可以控制反应的发生与停止 c 酸 氯化钙 红 CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应物的浓度(或盐酸的浓度或盐酸的质量分数) <
2KCl+3O2↑ 检查装置气密性 磨砂 Zn+H2SO4=ZnSO4+H2↑ 可以控制反应的发生与停止 c 酸 氯化钙 红 CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应物的浓度(或盐酸的浓度或盐酸的质量分数) <
【解析】
Ⅰ:(1)仪器a是集气瓶;故填:集气瓶。
(2)A的试管中没有放棉花,是利用氯酸钾在二氧化锰催化作用下加热分解生成氯化钾和氧气,反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;实验操作时,组装好仪器后,应先检查装置气密性,再添加药品;若选择装置C收集满氧气后,应先用玻璃片磨砂的一面盖住集气瓶口,再移出水槽正放在桌面上;故填:2KClO3
2KCl+3O2↑;实验操作时,组装好仪器后,应先检查装置气密性,再添加药品;若选择装置C收集满氧气后,应先用玻璃片磨砂的一面盖住集气瓶口,再移出水槽正放在桌面上;故填:2KClO3![]() 2KCl+3O2↑;检查装置气密性;磨砂。
2KCl+3O2↑;检查装置气密性;磨砂。
(3)锌粒与稀硫酸反应生成硫酸锌和氢气,该反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;若用装置B制氢气,该装置的优点是可以控制反应的发生与停止;氢气密度小于空气,若用装置F排空气法收集氢气,气体应从c端进入。故填:Zn+H2SO4=ZnSO4+H2↑;可以控制反应的发生与停止;c。
Ⅱ:(1)小亮取上述反应后的清液,滴在pH试纸上,把试纸呈现的颜色与标准比色卡对照,测得溶液pH=2,说明溶液显酸性,由此得出猜想一不成立的结论;故答案为:酸;
(2)小华认为此结论不够严谨,还应考虑生成物对溶液酸碱度的影响,补充了如下实验,①取洁净的烧杯,另配制氯化钙溶液,测得溶液pH=7;
②取洁净的试管,加入适量水和紫色石蕊溶液,持续通入CO2,发现溶液变为红色;故答案为:①氯化钙;②红;
[实验探究2]碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
[得出结论]根据以上实验探究,可得出影响反应能否进行的因素之一是:反应物的浓度或盐酸的浓度或盐酸的质量分数;故答案为:反应物的浓度(或盐酸的浓度或盐酸的质量分数);
[反思交流]
取出[实验探究2]所得的部分清液,放置一段时间后,测得pH为X,同时测得[实验探究2]容器中剩余清液的pH为Y,若X<Y,则她的猜想成立;故答案为:<.

【题目】通过学习,我们可以从化学的角度看问题。豆浆机由于快捷方便而进入千家万户。请根据图示回答:
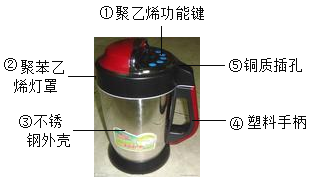
(1)制作材料中属于金属或合金的是_____(选填一种物质编号),属于有机合成材料的是_____(选填一种物质编号);
(2)制作手柄的塑料属于_____塑料(填“热塑性”或“热固性”);
(3)豆浆已成为众多家庭的早餐饮品,以下是豆浆中一些营养成分的平均质量分数。请根据下表回答:
成分 | 水 | 蛋白质 | 脂肪 | 糖类 | 钙 | 磷 | 铁 | 维生素A |
质量分数/% | 96.0 | 1.8 | 0.7 | 1.1 | 0.01 | 0.03 | 0.0005 | 0.015 |
①豆浆中含有的微量元素是_____;
②青少年缺乏_____元素易患有佝偻病。
③在豆浆所含的营养素中能供给人体能量的营养素有_____。
④若成年人每天食用90g豆浆,则摄入蛋白质的质量为_____g。