题目内容
【题目】(5分)在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示。
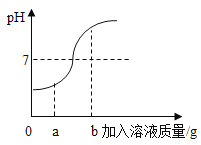
(1)该反应的化学方程式为 。
(2)该实验操作是将 滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,所得溶液中的溶质为 (写化学式)。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈 色。
【答案】(1)HCl+NaOH==NaCl+H2O (2)氢氧化钠溶液 (3)NaCl HCl (4)红
【解析】
试题分析:(1)稀盐酸与氢氧化钠反应生成的是氯化钠和水;HCl+NaOH==NaCl+H2O;
(2)由反应的PH 变化可知,溶液的起始PH<7,说明是氢氧化钠滴入盐酸中;
(3)由图可知,当加入溶液的质量为a g时,所得溶液的PH<7,即酸过量,那么溶液中的溶质有:过量的盐酸和生成的氯化钠;
(4)当加入溶液的质量为b g时,溶液的PH>7,即溶液呈碱性,碱性溶液能使无色的酚酞试液变成红色。

【题目】焙制糕点所用的发酵粉的主要成分之一是碳酸氢钠。某化学兴趣小组对碳酸氢钠的化学性质进行探究:
(探究实验一)实验室里,可用_____测定碳酸氢钠溶液的酸碱度。若测得碳酸氢钠溶液的pH为10,由此得出的结论是碳酸氢钠溶液显_____。
(探究实验二)碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如图所示。
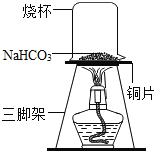
(查阅资料)碳酸氢钠受热易分解,生成水、二氧化碳气体和一种常见的固体物质。
(1)加热一段时间后观察烧杯内壁有水珠.
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到_____;
(3)该兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是_____;
②请设计实验,检验反应后的固体产物是NaOH或Na2CO3,并完成如表:
限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
序号 | 实验操作 | 预期现象 | 结论 |
Ⅰ | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,加入足量_____,振荡,静止 | 产生白色沉淀 | 产物含Na2CO3 |
Ⅱ | 取Ⅰ操作后的上层清液于试管B中,滴加酚酞溶液 | _____ | 产物不含NaOH |
【题目】化学兴趣小组的同学获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。同学们将少量柠檬酸和这种白色粉未溶于水,混合后产生了使澄清石灰水变浑浊的气体,于是他们对白色粉末的化学成分进行了以下探究:
(提出猜想)猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.___________。
(查阅资料)①碳酸钠溶液、碳酸氢钠溶液均呈碱性;② 碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解
(实验探究)兴趣小组设计不同实验方案进行探究。
甲组方案:将白色粉末溶于水后用pH试纸测定其酸碱度,pH>7猜想1正确
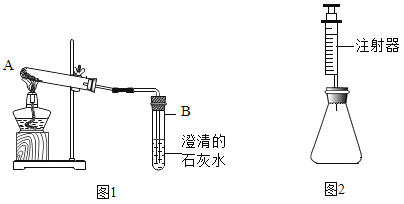
乙组方案:如图1,取适量白色粉末于试管中,将导管伸入澄清石灰水,加热,澄清石灰水变浑浊,猜想2正确,写出装置B中反应的化学方程式______________。
丙组方案:用如图2所示装置作为反应容器,准确测量生成气体的体积以判断白色粉末的成分。分别向盛有碳酸钠、碳酸氢钠和白色粉末的锥形瓶中,注入等体积、等浓度的足量的稀盐酸,记录如表:
实验编号 | 锥形瓶内物质[来源 | 最终得到 CO2 体积/mL | |
名称 | 质量/g | ||
① | 碳酸钠 | a | V1 |
② | 碳酸氢钠 | a | V2 |
③ | 白色粉末 | m | V3 |
实验①的化学反应方程式为____________; 表中 m=_______g; 根据上表中数据分析,猜想3正确,判断的依据是__________。
(交流反思)大家讨论后认为甲、乙组的结论都不准确:不准确的原因,甲是__________;乙是_____________。
(结论分析)探究后他们核查到添加剂的成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
(拓展应用)下列物质常温下放置一段时间也会分解的是________(填序号)。
A 碳酸 B 氨水 C 碳酸氢铵 D 盐酸