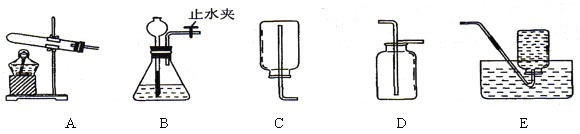
题目内容
【题目】为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀,过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。其中加入的碳酸钠的作用是_____,写出氯化钡发生反应的化学方程式_____。
【答案】除去氯化钙和过量的氯化钡 ![]()
【解析】
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡,故向滤液中加入适量的盐酸得到精盐水,其中加入的碳酸钠的作用是除去氯化钙和过量的氯化钡。氯化钡与碳酸钠溶液反应生成碳酸钡沉淀和氯化钠,反应的化学方程式为: ![]() 。
。

【题目】固体酒精,因使用、运输和携带方便,燃烧时对环境的污染较少,与液体酒精比较安全性较高,作为一种固体燃料,广泛应用于餐饮业、旅游业和野外作业的等场合。在一次用餐中,同学们对固体酒精产生了好奇,于是对其成分进行研究。

(查阅资料)(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。(2)氯化钙、氯化钡溶液均呈中性。(3)浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳。
探究活动一:探究固体酒精的成分
(提出问题)(1)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
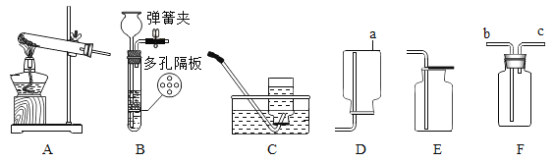
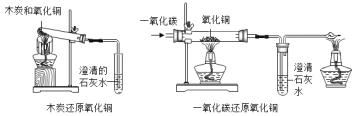
(实验探究)(1)按右图实验,发现澄清石灰水变浑浊,由此可得出酒精中含有碳元素的结论,此结论__________(选填“合理”或“不和理”)。

(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,取沉淀与试管中加稀盐酸,有气泡产生,写出产 生气体的化学方程式:______________ 。分析实验并结合资料得出氢氧化钠已变质。
(3)为进一步确定氢氧化钠的变质程度,分组探究。
①甲组烧杯上层清夜于两支试管中,按下图探究。
方案 | | |
现象 | 溶液变红 | 产生 |
结论 | 清液中有氢氧化钠 | 清夜中有碳酸钠 |
②乙组认为甲组实验不能证明清夜中一定有氢氧化钠,理由与是_______________。他们另取烧杯中上层清夜,加足量氯化钡溶液,充分反应后滴加酚酞溶液,酚酞溶液变红。
(实验结论)经讨论一致认为固体酒精中的氢氧化钠部分变质。
(拓展应用)要除取部分变质的氢氧化钠溶液中的杂质,可选择适量的__________(选填字母序号)。
ABa(OH)2溶液 BCaCI2溶液 CCa(OH)2
探究活动二:探究固体酒精中碳酸钠的质量分数利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)。
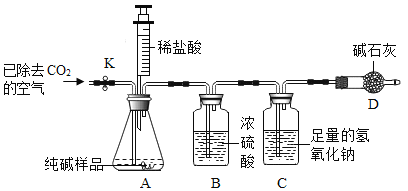
(1)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置的A和B中含有的__________,再接上装置C和D。
(2)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应)。
(3)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿。根据质量守恒定律,装置_________(填序号)在反应前后的质量差就是产生CO2的质量,由此计算出该固体酒精中Na2CO3的质量分数。若没有装置D,将会使测定结果______________(选填“偏大”或“偏小”)。