题目内容
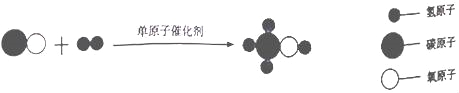
【题目】科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,其反应的微观过程如图所示。下列说法不正确的是( )
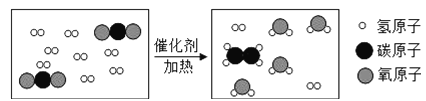
A.参加反应的两种分子的个数比是1:4
B.无机物在一定条件下可转化为有机物
C.该反前后原子种类、数目均不变
D.该反应的化学方程式为2CO2+6H2 C2H4+4H2O
C2H4+4H2O
【答案】A
【解析】
由反应的微观过程图可知,各物质反应的微粒个数关系是:
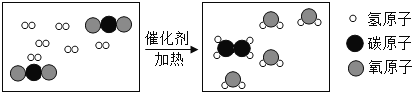
据微观示意图可知:CO2和H2在条件下转化为化工原料乙烯(C2H4)和水,配平即可,故其化学方程式为:2CO2+6H2 C2H4+4H2O。
C2H4+4H2O。
A、由方程式可知,参加反应的两种分子的个数比是1:3,故说法错误;
B、由物质的转化可知,无机物在一定条件下可转化为有机物,故说法正确;
C、根据质量守恒定律及微观示意图可知,反应前后原子种类、数目均不变,故说法正确;
D、由分析微观示意图可知,反应的方程式为:2CO2+6H2 C2H4+4H2O;故说法正确。
C2H4+4H2O;故说法正确。
故选A。

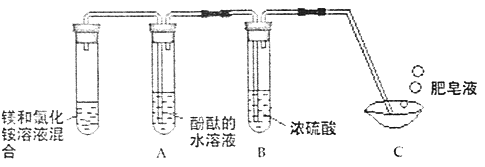
【题目】固体酒精,因使用、运输和携带方便,燃烧时对环境的污染较少,与液体酒精比较安全性较高,作为一种固体燃料,广泛应用于餐饮业、旅游业和野外作业的等场合。在一次用餐中,同学们对固体酒精产生了好奇,于是对其成分进行研究。

(查阅资料)(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。(2)氯化钙、氯化钡溶液均呈中性。(3)浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳。
探究活动一:探究固体酒精的成分
(提出问题)(1)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
(实验探究)(1)按右图实验,发现澄清石灰水变浑浊,由此可得出酒精中含有碳元素的结论,此结论__________(选填“合理”或“不和理”)。

(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,取沉淀与试管中加稀盐酸,有气泡产生,写出产 生气体的化学方程式:______________ 。分析实验并结合资料得出氢氧化钠已变质。
(3)为进一步确定氢氧化钠的变质程度,分组探究。
①甲组烧杯上层清夜于两支试管中,按下图探究。
方案 | | |
现象 | 溶液变红 | 产生 |
结论 | 清液中有氢氧化钠 | 清夜中有碳酸钠 |
②乙组认为甲组实验不能证明清夜中一定有氢氧化钠,理由与是_______________。他们另取烧杯中上层清夜,加足量氯化钡溶液,充分反应后滴加酚酞溶液,酚酞溶液变红。
(实验结论)经讨论一致认为固体酒精中的氢氧化钠部分变质。
(拓展应用)要除取部分变质的氢氧化钠溶液中的杂质,可选择适量的__________(选填字母序号)。
ABa(OH)2溶液 BCaCI2溶液 CCa(OH)2
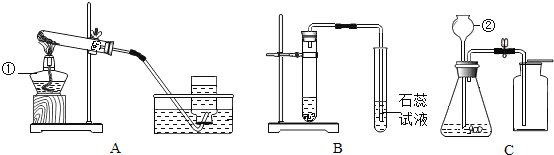
探究活动二:探究固体酒精中碳酸钠的质量分数利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)。
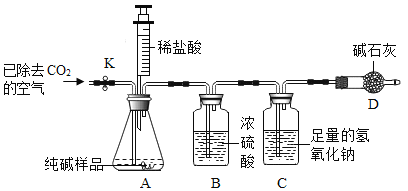
(1)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置的A和B中含有的__________,再接上装置C和D。
(2)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应)。
(3)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿。根据质量守恒定律,装置_________(填序号)在反应前后的质量差就是产生CO2的质量,由此计算出该固体酒精中Na2CO3的质量分数。若没有装置D,将会使测定结果______________(选填“偏大”或“偏小”)。
【题目】化学兴趣小组的同学获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。同学们将少量柠檬酸和这种白色粉未溶于水,混合后产生了使澄清石灰水变浑浊的气体,于是他们对白色粉末的化学成分进行了以下探究:
(提出猜想)猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.___________。
(查阅资料)①碳酸钠溶液、碳酸氢钠溶液均呈碱性;② 碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解
(实验探究)兴趣小组设计不同实验方案进行探究。
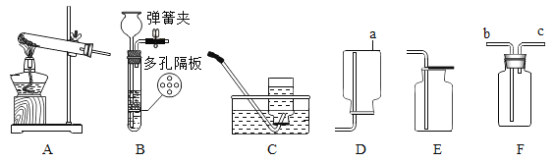
甲组方案:将白色粉末溶于水后用pH试纸测定其酸碱度,pH>7猜想1正确
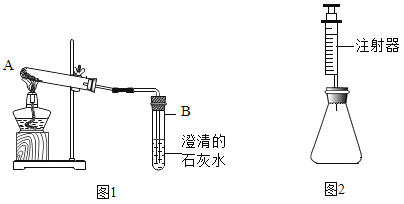
乙组方案:如图1,取适量白色粉末于试管中,将导管伸入澄清石灰水,加热,澄清石灰水变浑浊,猜想2正确,写出装置B中反应的化学方程式______________。
丙组方案:用如图2所示装置作为反应容器,准确测量生成气体的体积以判断白色粉末的成分。分别向盛有碳酸钠、碳酸氢钠和白色粉末的锥形瓶中,注入等体积、等浓度的足量的稀盐酸,记录如表:
实验编号 | 锥形瓶内物质[来源 | 最终得到 CO2 体积/mL | |
名称 | 质量/g | ||
① | 碳酸钠 | a | V1 |
② | 碳酸氢钠 | a | V2 |
③ | 白色粉末 | m | V3 |
实验①的化学反应方程式为____________; 表中 m=_______g; 根据上表中数据分析,猜想3正确,判断的依据是__________。
(交流反思)大家讨论后认为甲、乙组的结论都不准确:不准确的原因,甲是__________;乙是_____________。
(结论分析)探究后他们核查到添加剂的成分是柠檬酸和碳酸氢钠,分析后认为白色粉末中的碳酸钠是由碳酸氢钠分解产生的。
(拓展应用)下列物质常温下放置一段时间也会分解的是________(填序号)。
A 碳酸 B 氨水 C 碳酸氢铵 D 盐酸