题目内容
【题目】下列所示的图像能反映相对应实验的是
A.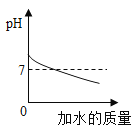 向pH=10的NaOH溶液中不断加水稀释
向pH=10的NaOH溶液中不断加水稀释
B.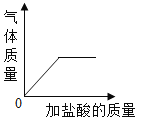 向碳酸钙固体中逐滴加入稀盐酸至过量
向碳酸钙固体中逐滴加入稀盐酸至过量
C.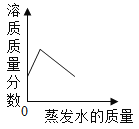 在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.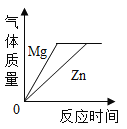 将足量的金属镁片和锌片分别和等质量的相同质量分数的稀硫酸混合
将足量的金属镁片和锌片分别和等质量的相同质量分数的稀硫酸混合
【答案】BD
【解析】
A、碱性溶液加水稀释,溶液不能变成酸性,即pH不可能小于7,错误;
B、向碳酸钙固体中逐滴加入稀盐酸至过量,当碳酸钙完全反应,产生二氧化碳的质量不再改变,正确;
C、在40℃,将饱和硝酸钾溶液恒温蒸发至有白色晶体析出,其溶液的溶质质量分数不变,错误;
D、过量镁和锌分别与硫酸反应时,生成的氢气质量相等,并且因为镁比锌活泼,所以反应速率快,故正确;
故选:BD。

【题目】人类的生活和生产都离不开金属,铁是世界产量最高且应用最广泛的金属。
(1)生活中用铁锅作炊具,是利用了铁的____性;
(2)铁制品生锈的主要条件是铁与____直接接触,铁锈的主要成分是____(填化学式);防止铁生锈的方法有____(答一种即可)。
(3)Pb的化合价有+2和+4价,Pb3O4属氧化物,也属于盐,其盐的化学式可表示为Pb2(PbO4),铁的氧化物Fe3O4也属于盐,则其盐的化学式可表示为____;
(4)取某钢样粉末50.0 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到2.5 g白色沉淀。另取三份不同质量的该钢样粉末分别加入到100.0 g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | 甲 | 乙 | 丙 |
加入钢样粉末的质量(g) | 10.0 | 20.0 | 40.0 |
生成气体的质量(g) | 0.355 | 0.71 | 1.0 |
①根据表中数据可计算出稀硫酸中H2SO4的质量分数为____;
②若要使实验甲中的剩余硫酸全部消耗完,则至少需要再加入____g钢样粉末。
【题目】下列有关物质的鉴别、除杂、分离所用的试剂或方法正确的是
选项 | 实验目的 | 所用试剂或方法 |
A | 检验甲烷中是否含有氢气 | 将气体点燃 |
B | 鉴别水和 | 分别加入二氧化锰 |
C | 除去氯化钾溶液中的少量氯化镁 | 加入适量氢氧化钠溶液 |
D | 除去氮气中混有的二氧化碳 | 将气体缓缓通过氢氧化钠溶液后干燥 |
A. AB. BC. CD. D