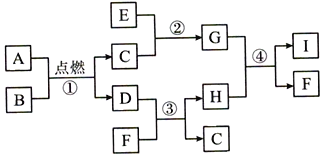
��Ŀ����
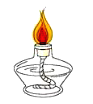
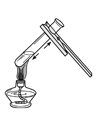
����Ŀ������ͼ��ʾ�����ڸܸ�ƽ���ʼ����ʵ�顣
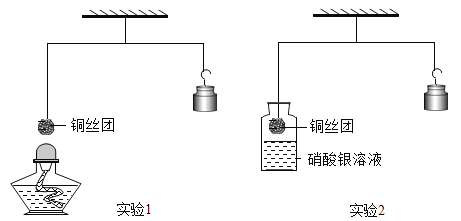
(1)ʵ��1������ϸͭ˿��һ��ʱ������߾ƾ��ƣ�ͭ˿��Ϊ��ɫ(CuO)���۲쵽ϸͭ˿��____(���������������½�������������)���������������ԭ����____��
(2)ʵ��2����ͭ˿�Ž�����������Һһ��ʱ�䣬���۲쵽��Һ��Ϊ��ɫʱС�ĵ����֣������ȶ�����������ʼλ��____(��ߡ��͡�����)��д��ƿ�з�Ӧ�Ļ�ѧ����ʽ___����Ӧ��������____��
���𰸡��½� �������ж�����Ԫ�ص����� �� Cu+ 2AgNO3=2Ag+ Cu��NO3��2 �û���Ӧ
��������
��1��ͭ��������Ӧ����������ͭ���������ж�����Ԫ�ص���������ͭ˿���½���
��2��ͭ����������Ӧ�ķ���ʽΪ��Cu+ 2AgNO3=2Ag+ Cu��NO3��2����֪��Ӧ�������������ӣ���������������÷�Ӧ�ǵ��ʺͻ����ﷴӦ�����µ��ʺ��»�����ķ�Ӧ�������û���Ӧ��

����Ŀ��ijͬѧ��һ������������Na2CO3��Һ����Na2CO3��CaCl2===CaCO3����2NaCl��ʵ�顣�����ʵ�������±���ʾ��
ʵ����� | �Ȼ��Ƶ�����/g | ̼������Һ������/g | ̼��Ƶ�����/g |
1 | 5.55 | 200 | 5 |
2 | 11.1 | 200 | 10 |
3 | 22.2 | 200 | 20 |
4 | 33.3 | 250 | 25 |
5 | 55.5 | 400 | X |
����ʵ�����ش��������⣺
(1)��______(�����)�η�Ӧ̼������ʣ�ࣻ
(2)����X��ֵ��_____��
(3)̼������Һ�����ʵ���������Ϊ______��
����Ŀ����������ͭ��ͭ�Ļ�������ɷֽ��з�����ȡ10g����Ʒ�������з���μ�����ͬ��������������ϡ���ᣬʹ֮��ַ�Ӧ��ÿ������ϡ�����������ʣ������������¼���±���(��Ӧ�Ļ�ѧ����ʽ��CuO+H2SO4�TCuSO4+H2O)�Իش��������⣺
��һ�� | �ڶ��� | ������ | ���Ĵ� | ����� | |
����ϡ���������/g | 20 | 20 | 20 | 20 | 20 |
��ַ�Ӧ��ʣ���������/g | 8 | 6 | 4 | 3 | m |
(1)����������m��ֵΪ_____��10g��Ʒ��CuO������Ϊ______g��
(2)����������ϡ���������ʵ���������_______��
(3)�������������Һ������ͭ����������_________(��ȷ��0.1%)