题目内容
【题目】人类的生活和生产都离不开金属,铁是世界产量最高且应用最广泛的金属。
(1)生活中用铁锅作炊具,是利用了铁的____性;
(2)铁制品生锈的主要条件是铁与____直接接触,铁锈的主要成分是____(填化学式);防止铁生锈的方法有____(答一种即可)。
(3)Pb的化合价有+2和+4价,Pb3O4属氧化物,也属于盐,其盐的化学式可表示为Pb2(PbO4),铁的氧化物Fe3O4也属于盐,则其盐的化学式可表示为____;
(4)取某钢样粉末50.0 g(假设只含Fe和C),在氧气流中充分反应,将产生的气体通入足量的澄清石灰水中,得到2.5 g白色沉淀。另取三份不同质量的该钢样粉末分别加入到100.0 g质量分数相同的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
实验序号 | 甲 | 乙 | 丙 |
加入钢样粉末的质量(g) | 10.0 | 20.0 | 40.0 |
生成气体的质量(g) | 0.355 | 0.71 | 1.0 |
①根据表中数据可计算出稀硫酸中H2SO4的质量分数为____;
②若要使实验甲中的剩余硫酸全部消耗完,则至少需要再加入____g钢样粉末。
【答案】导热 氧气和水 Fe2O3 刷漆等 Fe2(FeO4) 49% 18.17g
【解析】
(1)生活中用铁锅作炊具,是利用了铁的导热性;
(2)铁制品生锈的主要条件是铁与氧气和水直接接触,铁锈的主要成分是Fe2O3;防止铁生锈的方法有刷漆、涂油等。
(3)Pb的化合价有+2和+4价,Pb3O4属氧化物,也属于盐,其盐的化学式可表示为Pb2(PbO4),铁的氧化物Fe3O4也属于盐,则其盐的化学式可表示为:Fe2(FeO4);
(4)由表中的数据可知,每10.0钢样粉末完全反应生成氢气的质量为0.355g,则丙生成氢气的质量为应为1.42g>1g,说明了稀硫酸完全发生了反应。
①设稀硫酸中溶质的质量为x
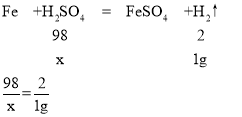
x=49g
稀硫酸中H2SO4的质量分数为:![]() ×100g=49%
×100g=49%
②设100g稀硫酸反应的钢样品的质量为y,由上述分析可知:
10.0g:0.355g=y:1g 解得:y≈28.17g
所以:若要使实验甲中的剩余硫酸全部消耗完,则至少需要再加入钢样品的质量为:28.17g-10.0g=18.17g。
故答为:(1)导热;(2)氧气和水,Fe2O3,刷漆等;(3)Fe2(FeO4);(4)①49%;②18.17g.

 阅读快车系列答案
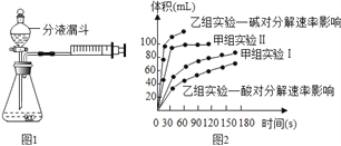
阅读快车系列答案【题目】现甲、乙两化学小组安装两套如图1的相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
(1)下列方法能检查该装置气密性的是 。
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)二氧化锰催化下过氧化氢分解的文字或符号表达式是 。
(3)甲小组有如下实验设计方案,完成下表
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究 对 过氧化氢分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%过氧化氢 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%过氧化氢 |
(4)甲、乙两小组得出如图2的数据
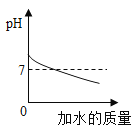
Ⅰ甲组实验得出的数据可知:浓度越大,过氧化氢分解速率 ;(填“越快”或“越慢”)
Ⅱ由乙组研究的酸、碱对过氧化氢分解影响因素的数据分析:相同条件下,过氧化氢在 (填“酸”或“碱”)性环境下放出气体速率较快。