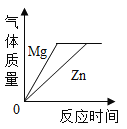
题目内容
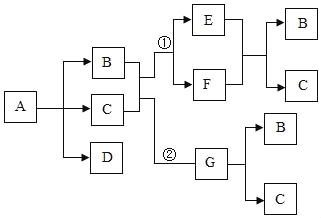
【题目】某化学兴趣小组对某铜锌合金样品进行探究实验。
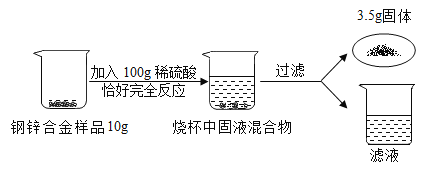
(1)写出题中发生反应的化学方程式_____;
(2)根据已知条件列出求解硫酸溶质质量(X)的比例式_____;
(3)铜锌合金中,Zn的质量是_____;
(4)求硫酸溶液中溶质质量分数_____;
(5)上述题中所用的稀硫酸是由_____g98%的浓硫酸配置成的,在稀释过程加入水_____g
【答案】![]()
![]() 6.5g 9.8% 10g 90g
6.5g 9.8% 10g 90g
【解析】
(1)铜与稀硫酸不发生反应,该反应为锌与稀硫酸反应生成硫酸锌和氢气的反应,反应的化学方程式为;![]() ;
;
(2)样品与100g稀硫酸恰好完全反应,故参加反应的锌的质量为10g-3.5g=6.5g,则
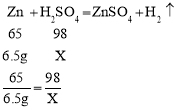
故求解硫酸溶质质量(X)的比例式为![]() ;
;
(3)样品与100g稀硫酸恰好完全反应,滤渣质量为合金中铜的质量,故铜锌合金中,Zn的质量是10g-3.5g=6.5g;
(4)由反应方程式:
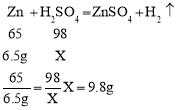
故硫酸溶液中溶质质量分数为![]() ;
;
(5)根据溶液稀释,溶质质量不变,设配制100g9.8%的稀硫酸需要yg98%的浓硫酸,则![]() ,故上述题中所用的稀硫酸是由10g98%的浓硫酸配置成的,在稀释过程加入水的质量为100g-10g=90g。
,故上述题中所用的稀硫酸是由10g98%的浓硫酸配置成的,在稀释过程加入水的质量为100g-10g=90g。

练习册系列答案
相关题目
【题目】某同学用一定质量分数的Na2CO3溶液做“Na2CO3+CaCl2===CaCO3↓+2NaCl”实验。其五次实验结果如下表所示:
实验次数 | 氯化钙的质量/g | 碳酸钠溶液的质量/g | 碳酸钙的质量/g |
1 | 5.55 | 200 | 5 |
2 | 11.1 | 200 | 10 |
3 | 22.2 | 200 | 20 |
4 | 33.3 | 250 | 25 |
5 | 55.5 | 400 | X |
根据实验结果回答下列问题:
(1)第______(填序号)次反应碳酸钠有剩余;
(2)表中X的值是_____;
(3)碳酸钠溶液中溶质的质量分数为______。