题目内容
【题目】金属和金属材料在生产生活中有广泛的用途。请回答下列问题:
(1)铜可以拉成铜丝,这是利用金属铜的_____
(2)铁制品锈蚀的过程,实际上是铁跟空气中的_____同时接触发生化学反应的过程;工厂用稀硫酸除去铁锈的原理是_____![]() 用化学方程式表示);为什么铝比铁更耐腐蚀_____
用化学方程式表示);为什么铝比铁更耐腐蚀_____
(3)铁制品长期使用容易生锈,在铁制品表面镀铬(Cr)可以防止铁生锈,工业上获取镀铬原料三氧化铬的化学反应方程式为:Na2Cr2O7+X=2CrO3+Na2SO4+H2O,其中X的化学式为_____.
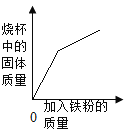
(4)将一定量的锌粉加入到硝酸银、硝酸铜的混合溶液中,充分反应后过滤,向滤渣中加入盐酸无气泡产生,则下列叙述中完全正确的是_____
①滤渣中一定含有银,一定不含有铜
②滤液中的溶质一定含有硝酸锌,一定不含有硝酸银
③若滤液为蓝色,则滤液中的溶质一定含有硝酸铜和硝酸锌
④若滤液为无色,则滤渣中一定含有银和铜,滤液中的溶质一定只含有硝酸锌
【答案】延展性 水分和氧气 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 铝与空气中的氧气反应生成了致密坚固的氧化铝薄膜 H2SO4 ③④
【解析】
(1)铜具有良好的延展性,所以铜可以拉成铜丝,故填延展性。
(2)铁生锈是铁跟空气中的水分和氧气同时接触发生化学反应的缘故,故填水分和氧气;
用稀硫酸除去铁锈的反应是铁锈的主要成分氧化铁与硫酸反应生成硫酸铁和水,故反应的化学方程式写为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
铝比铁更耐腐蚀是因为铝与空气中的氧气反应生成了致密坚固的氧化铝薄膜覆盖在金属表面,隔离了氧气,对内层的金属起保护作用,故填铝与空气中的氧气反应生成了致密坚固的氧化铝薄膜。
(3)由化学方程式可知,生成物中Cr、O、Na、S、H原子个数分别为2、11、2、1、2,反应物中Na、Cr、O原子个数分别为2、2、7,根据化学反应前后原子种类、数目不变,则X中含有2个氢原子、1个硫原子和4个氧原子,则物质X的化学式为H2SO4,故填H2SO4。
(4)①将一定量的锌粉加入到硝酸银、硝酸铜的混合溶液中,锌先与硝酸银反应生成硝酸锌和银,硝酸银反应完后,如果锌有剩余,再与硝酸铜反应,所以滤渣中一定含有银,可能含有铜,选项错误;
②将一定量的锌粉加入到硝酸银、硝酸铜的混合溶液中,锌先与硝酸银反应生成硝酸锌和银,如果加入的锌不足,则有可能锌完全反应后,硝酸银还有剩余,滤液中的溶质一定含有硝酸锌、硝酸银和硝酸铜,选项错误;
③滤液为蓝色,说明锌完全反应,硝酸铜有剩余,所以滤液中的溶质一定含有硝酸铜和硝酸锌,选项正确;
④滤液为无色,说明硝酸银与硝酸铜均完全与锌发生了反应,反应后生成硝酸锌和金属单质铜与银,所以滤渣中一定含有银和铜,滤液中的溶质一定只含有硝酸锌,选项正确,故填③④。

 寒假天地重庆出版社系列答案
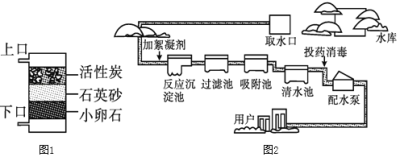
寒假天地重庆出版社系列答案【题目】实验室提供下列药品:碳酸钠固体、块状大理石、粉末状大理石、稀硫酸、稀盐酸和浓盐酸;A、B、C、D、E、F、G、H等装置和试管等仪器.
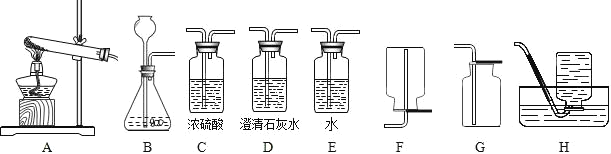
(1)制取CO2的发生装置选_____(填序号),按要求连接好装置后,在装入药品之前必不可少的操作_____.制CO2的装置还可以用来制取_____气体,其反应原理是:_____(用化学方程式表示).将装置A和装置H连接可制取我们常见的_____气体.
(2)检验二氧化碳的方法用化学方程式表示为_____.
(3)在四支试管中取等量固体和稀硫酸、稀盐酸反应,现象如表.
反应物 | ①粉末状大理石 +稀盐酸 | ②碳酸钠固体 +稀硫酸 | ③块状大理石 +稀盐酸 | ④块状大理石 +稀硫酸 |
现 象 | 剧烈,瞬间完成 | 剧烈,瞬间完成 | 有平稳气流产生 | 很慢,稍后停止 |
由此推知,实验室用于制取CO2的药品最合理的是_____(填序号);该反应的反应方程式为:_____.
(4)若要制取干燥的CO2,所有装置的连接顺序为_____.
(5)若不慎用浓盐酸代替稀盐酸制得了CO2气体,要得到纯净干燥的CO2,所有装置的连接顺序为_____.