题目内容
【题目】如图a、b、c三种固体物质的溶解度曲线,当他们的溶液接近饱和时,采用增加溶质、蒸发溶剂或升高温度三种办法,均可以变成饱和溶液是( )
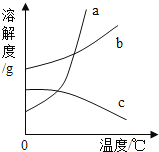
A.a B.b C.c D.ab
【答案】C
【解析】溶液接近饱和时,采用增加溶质、蒸发溶剂或升高温度三种办法,均可以变成饱和溶液,则该物质的溶解度应随着温度的升高而减小.
A、a的溶解度随着温度的升高而增大,升高温度后溶液仍为不饱和溶液,故选项错误.
B、b的溶解度随着温度的升高而增大,升高温度后溶液仍为不饱和溶液,故选项错误.
C、C的溶解度随着温度的升高而减小,升高温度后溶液变为饱和溶液;采用增加溶质、蒸发溶剂的方法,也可以变为饱和溶液,故选项正确.
D、由AB的分析,升高温度不能变为饱和溶液,故选项错误.
故选:C.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
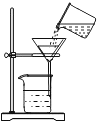
初中学业考试导与练系列答案【题目】我市某地盛产石灰石,其中含有不溶于盐酸的杂质.某化学兴趣小组为了测定石灰石中碳酸钙的含量,取10.0g石灰石样品,经粉碎后全部放入烧杯中,并加入适量的稀盐酸,使得稀盐酸和碳酸钙恰好反应。已知称量初始时刻的烧杯及所盛物质(石灰石和稀盐酸)的总质量为80.0g.(其中烧杯质量为62.8g)反应过程中测得烧杯及所盛物质的质量与相应时间记录如下表:
反应时间/分 | 0 | 2 | 4 | 6 | 8 | 10 |
烧杯及所盛物质质量/克 | 80.0 | 79.0 | 78.3 | 77.9 | 77.8 | 77.8 |
试计算:(1)反应结束后,共放出_____克的二氧化碳?
(2)反应结束后得到的溶液的溶质质量分数是____?(结果保留到小数点后一位)
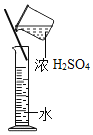
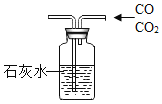
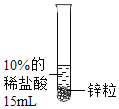
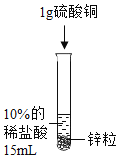
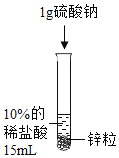
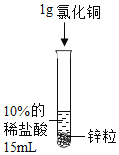
【题目】某化学兴趣小组对氢气的实验室制法,进行了一系列实验探究。
(1)小组用锌与稀盐酸反应制取氢气,该反应的化学方程式为_____。
(2)为了加快锌与稀盐酸的反应速率,老师提示可向反应物中加入少量硫酸铜固体,为了弄明白速率加快的原因,小组同学提出了以下猜想。
(猜想与假设)甲同学:可能与硫酸根离子有关;
乙同学:可能与铜离子有关;
丙同学:可能与铜单质有关。丙同学猜想的依据是_____。
设计并进行实验室温时,小组同学按下表进行实验,观察并记录现象。
实验序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
产生气泡的快慢 | 较快 | 明显加快 | 较快 | 明显加快 |
(分析并得出结论)
(3)由实验①和实验③发现反应速率几乎没有变化得出甲同学的猜想_____(选填“正确”或“不正确”)。
(4)实验④是将硫酸铜换成氯化铜进一步验证猜想,丙同学认为不需要替换试剂,只需通过观察实验②的现象就可以验证,该反应的现象为_____。此反应发生后反应速率加快依然较明显,小组同学得出_____的猜想正确。
(5)请你重新设计一个实验方案验证丙同学的猜想。实验方案:_____。