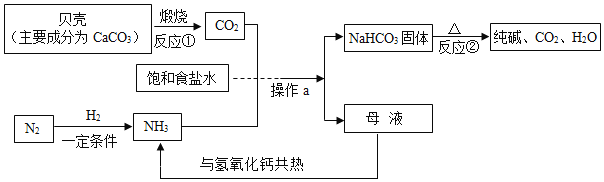
题目内容
【题目】下列图像能正确反映其对应变化关系的是
A. 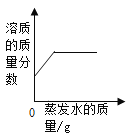 某温度下,将一定量饱和的氯化钠溶液恒温蒸发
某温度下,将一定量饱和的氯化钠溶液恒温蒸发
B. 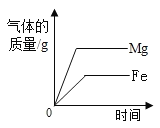 相同质量的等质量分数的盐酸分别与足量的固体反应
相同质量的等质量分数的盐酸分别与足量的固体反应
C. 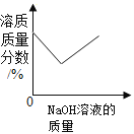 向一定量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
向一定量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液
D. 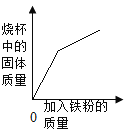 往盛有硫酸铜溶液的烧杯中加入铁粉至过量
往盛有硫酸铜溶液的烧杯中加入铁粉至过量
【答案】D
【解析】
A、影响固体溶解度的因素是温度,只要温度不变,溶解度就不变,所以恒温蒸发饱和氯化钠溶液中的水分时,氯化钠晶体析出,溶解度不变,饱和溶液溶质的质量分数=![]() ×100%则溶质质量分数不变,故选项错误;
×100%则溶质质量分数不变,故选项错误;
B、相同质量的等质量分数的盐酸分别与足量的固体反应,镁的活动性强于锌,故对应的曲线是镁比铁的斜率大;足量的固体反应,最终生成的氢气的质量取决于稀盐酸的量,故生成的氢气的量最终相等,故选项错误;
C、溶质的质量分数=![]() ,氢氧化钠先和溶液中的盐酸反应生成氯化钠和水,溶液质量增量为滴入的氢氧化钠的质量,溶质由氯化铜和稀盐酸变为氯化铜和未反应的稀盐酸和反应生成的氯化钠,溶质增量为部分稀盐酸变为氯化钠,故质量分数应逐渐变大,把盐酸消耗掉后,氢氧化钠和氯化铜反应生成沉淀,溶液的减少量为沉淀生成的量,溶质的减少量为铜离子的减少量,故此时溶质质量分数增大,故选项错误;
,氢氧化钠先和溶液中的盐酸反应生成氯化钠和水,溶液质量增量为滴入的氢氧化钠的质量,溶质由氯化铜和稀盐酸变为氯化铜和未反应的稀盐酸和反应生成的氯化钠,溶质增量为部分稀盐酸变为氯化钠,故质量分数应逐渐变大,把盐酸消耗掉后,氢氧化钠和氯化铜反应生成沉淀,溶液的减少量为沉淀生成的量,溶质的减少量为铜离子的减少量,故此时溶质质量分数增大,故选项错误;
D、向一定量硫酸铜溶液中不断加入铁粉,铁与硫酸铜反应生成铜和硫酸亚铁,即若加入56g铁,一定生成64g铜,固体质量增加64g,完全反应后,加入56g铁固体质量增加56g,故固体的质量不断增大,但恰好反应后曲线斜率变小,故选项正确。故选D。

【题目】我市某地盛产石灰石,其中含有不溶于盐酸的杂质.某化学兴趣小组为了测定石灰石中碳酸钙的含量,取10.0g石灰石样品,经粉碎后全部放入烧杯中,并加入适量的稀盐酸,使得稀盐酸和碳酸钙恰好反应。已知称量初始时刻的烧杯及所盛物质(石灰石和稀盐酸)的总质量为80.0g.(其中烧杯质量为62.8g)反应过程中测得烧杯及所盛物质的质量与相应时间记录如下表:
反应时间/分 | 0 | 2 | 4 | 6 | 8 | 10 |
烧杯及所盛物质质量/克 | 80.0 | 79.0 | 78.3 | 77.9 | 77.8 | 77.8 |
试计算:(1)反应结束后,共放出_____克的二氧化碳?
(2)反应结束后得到的溶液的溶质质量分数是____?(结果保留到小数点后一位)