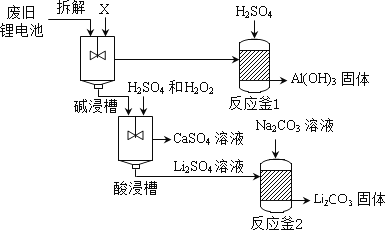
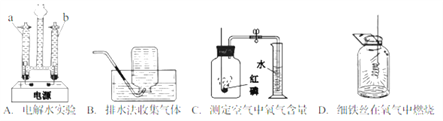
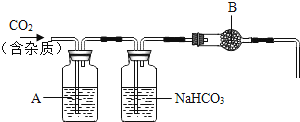
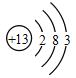
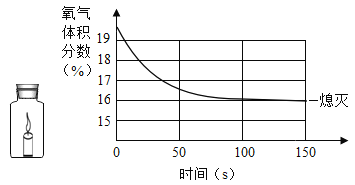
题目内容
【题目】如图为探究铝和铜的金属活动性强弱的实验先后图,下列说法不正确的是( )
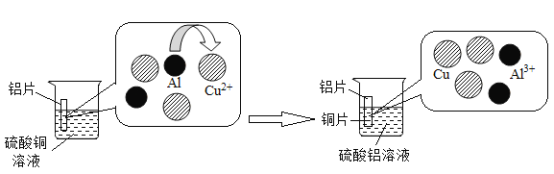
A.在反应过程中,观察到溶液颜色由蓝色变为无色
B.根据铝片表面有红色固体析出可以得出的铝活动性比铜强
C.反应后固体的质量比反应前增重了
D.其反应的化学方程式为![]()
【答案】D
【解析】
A、铜离子的水溶液呈蓝色,铝离子的水溶液呈无色,因为铝能与硫酸铜反应生成硫酸铝和铜,所以溶液的颜色会由蓝色变为无色,故A正确;
B、铝能与硫酸铜发生置换反应生成硫酸铝和铜,故铝的活动性比铜强,故B正确;
C、铝与硫酸铜反应的化学方程式为![]() ,根据化学方程式计算可知,反应生成铜的质量大于参加反应的铝的质量,则反应后固体的质量比反应前增重了,故C正确;
,根据化学方程式计算可知,反应生成铜的质量大于参加反应的铝的质量,则反应后固体的质量比反应前增重了,故C正确;
D、因为在化合物中铝常显+3价,铜常显+2价,所以铝与硫酸铜反应的化学方程式为![]() ,故D错误。
,故D错误。
故选D。

【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。
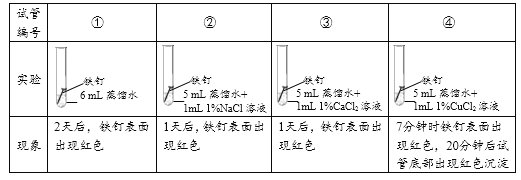
(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。