题目内容
【题目】过氧化钠(Na2O2)是一种淡黄色粉末状固体,能与水剧烈反应,生成氢氧化钠和氧气,小明利用过氧化钠进行制取氧气实验。
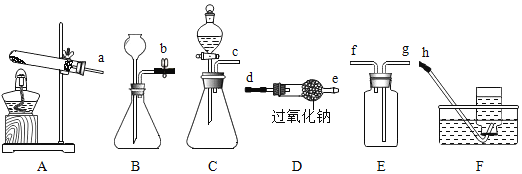
(1)小明要用过氧化钠制取并收集一瓶纯净、干燥的氧气,则上述导管口连接的顺序为_____。
(2)小明发现实验室有一瓶过氧化钠由于长期敞口暴露在空气中,已经变成了白色粉末状固体,该白色粉末状固体的主要成分是什么?_____(写化学式)。
(3)小明将过氧化钠固体放入硫酸铜溶液中,写出该反应总的化学反应方程式_____。
【答案】cdegf或cdeg Na2CO3 ![]()
【解析】
过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠与二氧化碳反应生成碳酸钠,过氧化钠固体放入硫酸铜溶液中过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠。
(1)过氧化钠和水反应生成氢氧化钠和氧气,反应在常温下进行,制取并收集一瓶纯净、干燥的氧气,选用C装置,然后由D装置干燥,用E装置收集,氧气从长管进,空气从短管排出,故导管口连接的顺序为cdegf或cdeg。
(2)小明发现实验室有一瓶过氧化钠由于长期敞口暴露在空气中,过氧化钠与二氧化碳反应生成碳酸钠,则变成了白色粉末状固体,该白色粉末状固体的主要成分是碳酸钠,故化学式为Na2CO3。
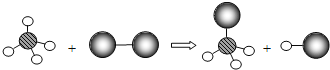
(3)过氧化钠固体放入硫酸铜溶液中过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠,反应的化学方程式为![]() 。
。

 阳光课堂课时作业系列答案
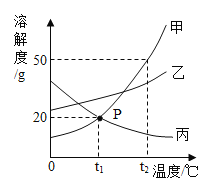
阳光课堂课时作业系列答案【题目】已知:烧杯中的水均为100g,表是KC1、KNO3在不同温度时的溶解度。
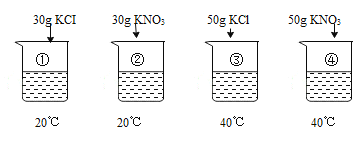
温度 | 20℃ | 40℃ |
KC1 | 34.0g | 40.0g |
KNO3 | 31.6g | 63.9g |
①~④所得溶液属于饱和溶液的是
A.①B.②C.③D.④
【题目】某兴趣小组探究氢氧化钠的性质时进行了如图所示的实验。观察到试管A中出现了白色沉淀,试管B中溶液变红色,可是过一会儿红色却消失。小组同学重新进行实验,但现象相同。为此同学进行了如下探究,请你参与:
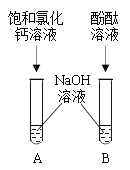
探究一:探究A试管现象产生的原因
[提出问题]A试管中产生白色沉淀的原因是什么?
[猜想]猜想一:氢氧化钠溶液中含有碳酸钠(猜想的依据是___________);猜想二:可能氢氧化钠溶液浓度较大。
[设计实验]
操作 | 现象 | 结论 |
_____________ | _____________ | 猜想一不正确,猜想二正确 |
写出A试管中发生反应的化学方程式_____________________。
探究二:探究B试管中溶液褪色的原因
[提出问题]是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
[猜想]甲同学:可能与O2有关;乙同学;可能与______________大小有关。
[设计实验]两位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 实验目的 | 现象 | 结论 |
① 将NaOH溶液加热煮沸 | __________ | 溶液先变红,后又变成无色 | 自己的猜想不正确 |
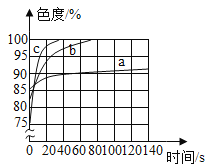
② 向冷却后的溶液中滴入酚酞,并滴一些植物油在其上方 | __________ |
(2)乙同学使用了色度传感器测溶液的颜色:他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH溶液然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图[说明:溶液无色时色度值(透过率)为100%]。乙同学实验的结论是________________。