题目内容
【题目】为了检测某石灰石样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的盐酸与样品充分反应来进行实验测定(样品中的杂质不溶于水,且不与盐酸反应),测得据如下表:
甲同学 | 乙同学 | 丙同学 | 丁同学 | |
所取石灰石样品质量(g) | 12.5 | 12.5 | 12.5 | 12.5 |
加入盐酸的质量(g) | 30.0 | 40.0 | 55.0 | 70.0 |
剩余固体的质量(g) | 6.5 | 4.5 | 2.5 | 2.5 |
试回答:
①样品中碳酸钙的质量分数为多少?.
②12.5g样品与足量稀盐酸反应后可产生二氧化碳多少克?(写出计算过程)
【答案】①80.0% ②4.4g(详见解析)
【解析】
当样品12.5g加酸至固体不再减少时,剩余固体不再含有碳酸钙,所以碳酸钙的质量为12.5g﹣2.5g=10.0g.
(1)样品中碳酸钙的质量分数=![]()
(2)设12.5g样品(碳酸钙质量为10.0g)酸反应得到的二氧化碳的质量为x.
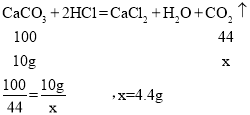
答:12.5g样品与足量稀盐酸反应后可产生二氧化碳4.4g.
故答案为:80.0%;4.4g.

 名校课堂系列答案
名校课堂系列答案【题目】化学是从微观角度研究物质的组成、结构及其变化的科学。
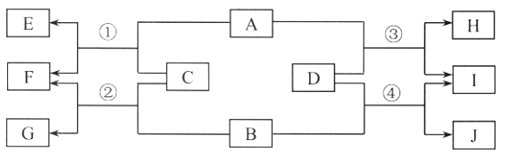
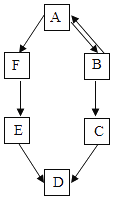
(1)构成物质的粒子之间的关系如图1所示,请回答下列问题:
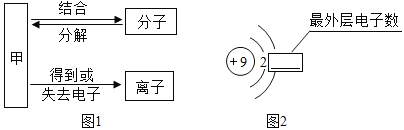
①A是________________。
②图2是氟元素的原子结构示意图,方框横线上的数字是________________,在化学反应中易__________电子(填“得到”或“失去”)。
③保持氯化氢气体化学性质的最小粒子是_______________(填符号)。
(2)己知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则核外电子数为___________。
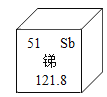
(3)如图是钠元素和氟元素在元素周期表中的信息。

由此信息得出:
① 钠元素的原子序数是________________。
②由钠元素与氟元素组成氟化钠的化学式为________________。
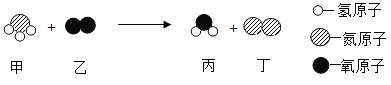
(4)甲、乙、丙、丁表示四种物质,部分物质的微观示意图见下表。甲和乙在一定条件下反应生成丙和丁。
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 | 化合物 |
|
|
|
请回答:若一定质量的化合物甲和48g的乙恰好完全反应,可生成44g丙和27g丁,则甲的化学式是________________。