题目内容
12. 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.为了验证该药物的主要成分是碳酸盐,他进行了如下实验:首先将药片放入试管中,向其中加入适量的稀盐酸,然后将生成的气体通入到澄清的石灰水中,石灰水变浑浊
(写后继实验操作和现象),证明碳酸盐的存在当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
【提出问题】抗酸药为什么嚼碎比整片服用效果好?
【作出猜想】他的猜想是嚼碎后服用疗效快.
【设计实验】
实验一:将一片完整的药片放入试管中,向其中加入5mL5%的稀盐酸;
实验二:将一片研碎的药片放入试管中,向其中加入5mL5%的稀盐酸.
【现象与结论】实验二比实验一反应快.证明小军的猜想正确.
【拓展探究】(1)氢氧化镁、氢氧化铝、碳酸氢钠等也常用于制作抗酸药,但氢氧化钠,氢氧化钙等物质却不能制成抗酸药,原因是有较强的腐蚀性.
(2)钡餐是X光透视常用的造影剂,检测者服用的钡餐主要成分是硫酸钡,若改用碳酸钡会造成被检测者重金属(离子)中毒,请用化学方程式表达中毒的原理:BaCO3+2HCl=BaCl2+H2O+CO2↑.
分析 物质与物质之间的接触面积越大,反应速率越快.人吃的药物必须具备一些条件,例如,对人体的危害程度要小,要起到治疗疾病的效果.利用反应的生成物来分析胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药的原因.
解答 解:
该药物的主要成分是碳酸盐,先将药片放入试管中,向其中加入适量的稀盐酸,然后验证生成的气体是不是二氧化碳就行,
故答案为:将生成的气体通入到澄清的石灰水中,石灰水变浑浊.
【作出猜想】药物说明书上的服用方法是嚼碎后服用,故他猜想的答案为:嚼碎后服用疗效快(或嚼碎后药物与胃酸的反应快;或反应物的接触面积增大,化学反应加快);
【设计实验】可以设计这样的实验来验证一是整片的药片和研碎的药片与盐酸反应,观察反应速度,从而得出小军的猜想正确.
故答案为:一片研碎的药片
【拓展探究】
(1)最后深入探究得出胃药必备的条件:一能中和胃酸,二对身体无害;氢氧化钠,氢氧化钙等物质却不能制成抗酸药,是因为氢氧化钠,氢氧化钙等有较强的腐蚀性;故答案为:有较强的腐蚀性;
(3)胃液中的盐酸能将不溶性的碳酸钡转化成可溶性的氯化钡,因此会使人中毒,方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑.
点评 该题最大的特点是通过问题情境,将胃药说明书探究的明明白白,使学生在做题中获得了生活常识,很有意义.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
2.氢气和氧气的混合气体37g,点燃充分反应生成水36g,则混合气体中氢气和氧气的质量比可能是( )
| A. | 1:36 | B. | 2:35 | C. | 5:32 | D. | 4:33 |
7.根据如图的实验,判断下列说法错误的是( )
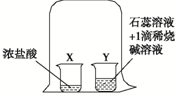

| A. | 说明浓盐酸有挥发性 | B. | 说明分子不断做无规则运动 | ||
| C. | 可观察到Y杯溶液的颜色变化 | D. | 说明氯化氢气体具有酸性 |
17.某工厂排放的废水经测定pH为3,为治理废水,需将pH调至8.为此,可向该废水中加入适量的( )
| A. | 生石灰 | B. | 硫酸 | C. | 水 | D. | 废铜屑 |
4.下列说法正确的是( )
| A. | 氧气是一种化学性质比较活泼的气体,它具有可燃性 | |
| B. | 凡是含有氧元素的物质都可以用作实验室制取氧气的原料 | |
| C. | 在通常情况下,氧气是无色、无味的气体 | |
| D. | 物理变化发生时一定发生化学变化 |
1.下列化学方程式错误的是( )
| A. | C+O2═CO2 | B. | 2HgO═2Hg+O2↑ | ||
| C. | P+O2═PO2 | D. | Fe+CuSO4═FeSO4+Cu |