题目内容
3.市售尿素中,主要成分甲酰胺[化学式为:CO(NH2)2].请回答:(1)甲酰胺的相对分子质量为60;
(2)甲酰胺中氮、氢三种元素质量比为7:1;
(3)甲酰胺中,氮元素的质量分数为46.7%;
(4)经测定,某块农田需补充氮元素93.4Kg,请计算需要施用甲酰胺多少千克?(写出计算过程)
分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据元素的质量比等于相对原子质量和的比进行解答;
(3)根据化合物中元素的质量分数的计算方法来分析;
(4)根据元素的质量=化合物的质量×化合物中该元素的质量分数来计算.
解答 解:(1)甲酰胺的相对分子质量为:12+16+(14+1×2)×2=60,故填:60;
(2)甲酰胺中氮、氢两种元素的质量比为(14×2):(1×4)=7:1,故填:7:1;
(3)甲酰胺中氮元素的质量分数=$\frac{14×2}{60}×100%$≈46.7%,故填:46.7%;
(4)需要施用甲酰胺的质量为:93.4kg÷46.7%=200kg,故填:200.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
11.下列物质依据氯元素化合价规律排列,次序为KC1、HClO、( )、KClO3、HClO4,则空格内的物质应是( )
| A. | NaCl | B. | C1O2 | C. | Cl2 | D. | HC1O3 |
15.氯化钠是由钠离子和氯离子构成的.已知钠离子(Na+)的原子核中质子娄为11,中子数为12,下列有关Na+的说法正确的是( )
| A. | 原子核外电子数为11 | B. | 它带1个单位的正电荷 | ||
| C. | 原子核内的正电荷数为+10 | D. | 在化学反应中很活泼 |
13.下列基本实验操作的图示正确的是( )
| A. | 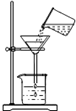 过滤 | B. | 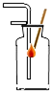 验满 | C. | 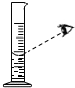 读取液体体积 | D. | 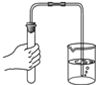 检查气密性 |
 计算是化学中常见的技能之一.
计算是化学中常见的技能之一. 某兴趣小组同学按照下图实验装置进行实验,请回答相关问题:
某兴趣小组同学按照下图实验装置进行实验,请回答相关问题: 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.