题目内容
20.实验室制取氧气常用的方法有三种,分别是过氧化氢溶液和二氧化锰、氯酸钾和二氧化锰的混合物、高锰酸钾.工业上采用分离液态空气法制取氧气,主要是利用氧气和氮气沸点不同,利用蒸发的方法来制取氧气的.用过氧化氢加入二氧化锰制取氧气的反应文字表达式是:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.分析 根据实验室制取氧气可用加热高锰酸钾、氯酸钾和二氧化锰的混合物,及分解过氧化氢的方法制取氧气解答.根据工业制取氧气的方法分析解答.
解答 解:实验室常采取利用二氧化锰催化过氧化氢溶液,加热高锰酸钾、氯酸钾和二氧化锰的混合物的方法制取氧气;空气中氮气约占空气体积的78%,氧气约占21%,因此工业上利用氧气和氮气的沸点不同,将空气液化除尘,将氮气分离出去,剩下的主要是液态氧,该变化过程中没有产生新物质,是物理变化;
用过氧化氢加入二氧化锰制取氧气的反应文字表达式是:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气;
故答案为:过氧化氢溶液和二氧化锰、氯酸钾和二氧化锰的混合物、高锰酸钾;分离液态空气;沸点;过氧化氢$\stackrel{二氧化锰}{→}$水+氧气.
点评 了解实验室制取氧气的方法、明确工业制取氧气的原理是解答此题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列物质依据氯元素化合价规律排列,次序为KC1、HClO、( )、KClO3、HClO4,则空格内的物质应是( )
| A. | NaCl | B. | C1O2 | C. | Cl2 | D. | HC1O3 |
15.氯化钠是由钠离子和氯离子构成的.已知钠离子(Na+)的原子核中质子娄为11,中子数为12,下列有关Na+的说法正确的是( )
| A. | 原子核外电子数为11 | B. | 它带1个单位的正电荷 | ||
| C. | 原子核内的正电荷数为+10 | D. | 在化学反应中很活泼 |
5.日常生活中,区别下列各组物质所用的方法,不正确的是( )
| A. | 白酒和白醋--闻气味 | B. | 棉线和羊毛线--灼烧,闻气味 | ||
| C. | 黄铜和黄金--观察颜色 | D. | 食盐和苏打--加醋,观察现象 |
9.现甲、乙两化学小组安装两套如图1相同装置,通过测定产生相同体积气体所用时间长短探究影响过氧化氢(H2O2)分解速率的因素.
(1)二氧化锰催化下过氧化氢分解的文字表达式是:双氧水$\stackrel{二氧化锰}{→}$水+氧气.
(2)甲小组有如下实验设计方案,完成下表.
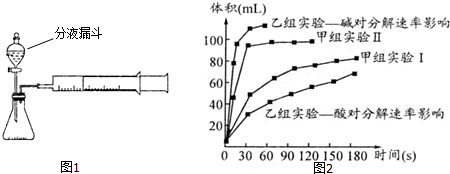
(3)甲、乙两小组得出如图2数据.
①甲组实验得出的数据可知:浓度越大,H2O2分解速率越快;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快.
(1)二氧化锰催化下过氧化氢分解的文字表达式是:双氧水$\stackrel{二氧化锰}{→}$水+氧气.
(2)甲小组有如下实验设计方案,完成下表.
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究浓度对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2溶液 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2溶液 |

(3)甲、乙两小组得出如图2数据.
①甲组实验得出的数据可知:浓度越大,H2O2分解速率越快;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快.
10.对化学符号中“3”所表示的含义,说法正确的是( )
| A. | 3O2--表示三个氧原子 | |
| B. | SO3--表示一个三氧化硫分子中含有三个氧元素 | |
| C. | 2Al3+--表示两个铝离子带三个单位的正电荷 | |
| D. | $\stackrel{-3}{Al}$N--表示氮化铝中,氮元素显-3价 |
 在“空气中氧气含量的测定”实验探究中,小涵设计了如下实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.(实验装置如图所示)回答下列问题:
在“空气中氧气含量的测定”实验探究中,小涵设计了如下实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.(实验装置如图所示)回答下列问题: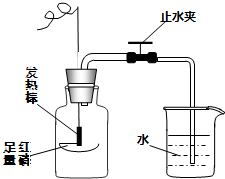 某兴趣小组同学按照下图实验装置进行实验,请回答相关问题:
某兴趣小组同学按照下图实验装置进行实验,请回答相关问题: 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.