题目内容
(11分)化学兴趣小组测定某石灰石样品中碳酸钙的质量分数(假定:石灰石样品中除碳酸钙外,其余物质不与稀盐酸反应也不溶于水)。
I 他们的方法是:(1)取3.0g样品放入烧杯;(2)加入足量的稀盐酸至恰好不再产生气体时,测定反应后生成的CO2质量;(3)根据CO2的质量求出样品中碳酸钙的质量及质量分数。
II 为测定CO2的质量,他们想出了以下方案,请帮助他们完成设计方案:
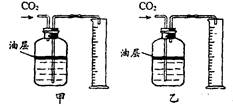
(1)选用如图 ▲ (填“甲”或“乙”)装置可测量产生的CO2的 ▲ ,再利用此时CO2的密度,可计算CO2的质量。图中瓶内水面上油层的作用是 ▲ 。
(2)他们选用该方案时测量的气体在常温下体积为440mL。已知常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 ▲ g。请根据化学反应方程式计算该石灰石样品中CaCO3的质量分数。
III 实验后小明提出用不同的方法测定某石灰石样品中碳酸钙的质量分数:(1)取mg样品放入烧杯;(2)加入足量的稀盐酸至不再产生气体时,过滤,洗涤、干燥后称量剩余固体质量为ng;(3)根据剩余固体的质量求出样品中碳酸钙的质量分数为 ▲ 。(用m、n的代数式表示)
Ⅳ 除了上述实验方法外,还可以采用的方法是: ▲ ,称量反应前后物质总质量的减小量。根据减小量求出样品中碳酸钙的质量及质量分数。
I 他们的方法是:(1)取3.0g样品放入烧杯;(2)加入足量的稀盐酸至恰好不再产生气体时,测定反应后生成的CO2质量;(3)根据CO2的质量求出样品中碳酸钙的质量及质量分数。
II 为测定CO2的质量,他们想出了以下方案,请帮助他们完成设计方案:
(1)选用如图 ▲ (填“甲”或“乙”)装置可测量产生的CO2的 ▲ ,再利用此时CO2的密度,可计算CO2的质量。图中瓶内水面上油层的作用是 ▲ 。

(2)他们选用该方案时测量的气体在常温下体积为440mL。已知常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为 ▲ g。请根据化学反应方程式计算该石灰石样品中CaCO3的质量分数。
III 实验后小明提出用不同的方法测定某石灰石样品中碳酸钙的质量分数:(1)取mg样品放入烧杯;(2)加入足量的稀盐酸至不再产生气体时,过滤,洗涤、干燥后称量剩余固体质量为ng;(3)根据剩余固体的质量求出样品中碳酸钙的质量分数为 ▲ 。(用m、n的代数式表示)
Ⅳ 除了上述实验方法外,还可以采用的方法是: ▲ ,称量反应前后物质总质量的减小量。根据减小量求出样品中碳酸钙的质量及质量分数。

分析:Ⅱ、(1)根据二氧化碳的性质来选择并根据装置的特点来完成该题的解答;
(2)根据密度公式可以求算出二氧化碳气体的质量;然后结婚碳酸钙与稀盐酸反应的化学方程式可以求得碳酸钙的质量,进而求算出碳酸钙的质量分数;
Ⅲ、根据质量守恒定律可以完成该题的解答;
Ⅳ、根据碳酸钙的性质来完成解答.
解答:解:Ⅱ(1)二氧化碳能够溶于水,所以为了使实验结果更准确,二氧化碳不能和水接触,所以应该选择甲装置,进入量筒中的水的体积即为二氧化碳的体积,而装置中油的作用就是为了防止二氧化碳溶于水而影响实验结果的;
(2)根据题意可知生成二氧化碳气体的体积为440mL=0.44L,所以根据密度公式可以知道生成二氧化碳气体的质量为:m=ρV=2.0g/L×0.44L=0.88g;
设石灰石样品中CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.88g
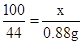
解得:x=2.0g
该石灰石样品中CaCO3的质量分数为:
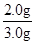 ×100%=66.7%;
×100%=66.7%;
答:该石灰石样品中CaCO3的质量分数为66.7%;
Ⅲ、根据质量守恒定律可以知道,反应前后固体的质量减少的质量即为被反应了的碳酸钙的质量,即为:(m-n)g,所以可以表示出样品中碳酸钙的质量分数为:
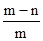 ×100%;
×100%;
Ⅳ、碳酸钙在高温下能够分解产生二氧化碳和氧化钙,所以可以将石灰石高温煅烧,来测量出石灰石样品中碳酸钙的质量分数.
故答案为:Ⅱ、(1)甲;体积;防止二氧化碳溶于水;
(2)0.88;66.7%;
Ⅲ、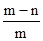 ×100%;
×100%;
Ⅳ、高温灼烧样品.
(2)根据密度公式可以求算出二氧化碳气体的质量;然后结婚碳酸钙与稀盐酸反应的化学方程式可以求得碳酸钙的质量,进而求算出碳酸钙的质量分数;
Ⅲ、根据质量守恒定律可以完成该题的解答;
Ⅳ、根据碳酸钙的性质来完成解答.
解答:解:Ⅱ(1)二氧化碳能够溶于水,所以为了使实验结果更准确,二氧化碳不能和水接触,所以应该选择甲装置,进入量筒中的水的体积即为二氧化碳的体积,而装置中油的作用就是为了防止二氧化碳溶于水而影响实验结果的;
(2)根据题意可知生成二氧化碳气体的体积为440mL=0.44L,所以根据密度公式可以知道生成二氧化碳气体的质量为:m=ρV=2.0g/L×0.44L=0.88g;
设石灰石样品中CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 0.88g
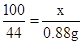
解得:x=2.0g
该石灰石样品中CaCO3的质量分数为:
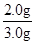 ×100%=66.7%;
×100%=66.7%;答:该石灰石样品中CaCO3的质量分数为66.7%;
Ⅲ、根据质量守恒定律可以知道,反应前后固体的质量减少的质量即为被反应了的碳酸钙的质量,即为:(m-n)g,所以可以表示出样品中碳酸钙的质量分数为:
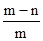 ×100%;
×100%;Ⅳ、碳酸钙在高温下能够分解产生二氧化碳和氧化钙,所以可以将石灰石高温煅烧,来测量出石灰石样品中碳酸钙的质量分数.
故答案为:Ⅱ、(1)甲;体积;防止二氧化碳溶于水;
(2)0.88;66.7%;
Ⅲ、
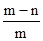 ×100%;
×100%;Ⅳ、高温灼烧样品.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目