题目内容
(2011年福建龙岩,18题)人体胃液中含少量HCl,正常情况下胃液的pH为0.8~1.5,相应含HCl的溶质质量分数为0.2%~0.4%,胃酸过多与过少都不利于人体健康。某人出现反胃、吐酸水的症状,经检查其胃液中HCl的质量分数为1.495%(胃液密度约为1g/cm3).
(1)若人的胃液总量约为100mL,请完成下列表格:
(2)医生给该患者开了一瓶胃舒平(每片含氢氧化铝0.39g),并要求病人每次服用2片,请根据化学方程式计算在食用该药片后被出去的HCl的质量是多少?(发生反应的化学方程式为Al(OH)3+3HCl==AlCl3+H2O)
(3)医生还提醒该胃药不宜过量服用,可能原因是 。(答一点即可)
(1)若人的胃液总量约为100mL,请完成下列表格:
| 正常情况下胃液中HCl的质量范围 | |
| 该患者胃液中HCl的质量 | |
| 该患者至少要除去的HCl的质量是 | |
(3)医生还提醒该胃药不宜过量服用,可能原因是 。(答一点即可)
(1)0.2~0.4g 1.495g 1.095g
(2)设食用药片后被除去的HCI的质量是X
AI(OH)3+3HCI=AICI3+3H2O
109.5
2×0.39g x
78:109.5=2×0.39g: x
X=1.095g
(3)过多的胃药因消耗胃内过多盐酸,不利于健康(其他合理答案也可)
(2)设食用药片后被除去的HCI的质量是X
AI(OH)3+3HCI=AICI3+3H2O
109.5
2×0.39g x
78:109.5=2×0.39g: x
X=1.095g
(3)过多的胃药因消耗胃内过多盐酸,不利于健康(其他合理答案也可)
(1)人的胃液总量约为100mL(胃液密度约为1g/cm3),且相应含HCl的溶质质量分数为0.2%~0.4%,
根据溶质的质量分数=
 %,溶质质量=溶液质量×溶质质量分数,其中盐酸溶液的质量为:100mL×1g/cm3=100g,则盐酸的质量范围为100g×0.2%~100g×0.4%,0.2g~0.4g;
%,溶质质量=溶液质量×溶质质量分数,其中盐酸溶液的质量为:100mL×1g/cm3=100g,则盐酸的质量范围为100g×0.2%~100g×0.4%,0.2g~0.4g;该患者胃液中HCl的质量=100g×1.495%=1.495g;
人体需要的最大盐酸量是0.4g,那么该患者至少要除去的HCl的质量是1.495g﹣0.4g=1.095g;
(2)设食用该药片后被除去的盐酸的质量是x
Al(OH)3+3HCl═AlCl3+3H2O
78 109.5
2×0.39g x
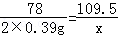
解之得:x=1.095g
过多的胃药因消耗胃内过多盐酸,不利于健康;
故答案为:
(1)0.2g~0.4g; 1.495g; 1.095g;
(2)食用该药片后被出去的HCl的质量是1.095g;过多的胃药因消耗胃内过多盐酸,不利于健康.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目