题目内容
(9分)黄铜(由锌和铜形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为了测定黄铜屑样品组成,分四次取样品与稀硫酸反应,其实验数据记录如下表:
计算:
(1)黄铜样品(25.0g)中锌的质量
(2)所用稀硫酸中溶质质量分数
| | 1 | 2 | 3 | 4 |
| 样品质量/g | 25.0 | 25.0 | 25.0 | 30.0 |
| 稀硫酸质量/g | 80 | 100 | 120 | 100 |
| 产生气体质量/g | 0.4 | 0.5 | 0.5 | 0.5 |
计算:
(1)黄铜样品(25.0g)中锌的质量
(2)所用稀硫酸中溶质质量分数
本题共9分
解:设样品中Zn的质量为x,稀硫酸中溶质质量为y
Zn+H2SO4=====ZnSO4+ H2↑ 1分
65 2
x 0.5 g
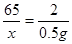 2分
2分
x="16.25" g 1分
Zn+H2SO4=====ZnSO4+ H2↑
98 2
y 0.4g
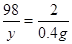 2分
2分
y="19.6" g 1分
所用稀硫酸中溶质质量分数 1分
1分
其它合理回答也给分
答:样品中锌的质量16.25,所用稀硫酸中溶质质量分数24.5%。设、答完整 1分
解:设样品中Zn的质量为x,稀硫酸中溶质质量为y
Zn+H2SO4=====ZnSO4+ H2↑ 1分
65 2
x 0.5 g
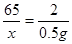 2分
2分x="16.25" g 1分
Zn+H2SO4=====ZnSO4+ H2↑
98 2
y 0.4g
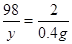 2分
2分y="19.6" g 1分
所用稀硫酸中溶质质量分数
 1分
1分其它合理回答也给分
答:样品中锌的质量16.25,所用稀硫酸中溶质质量分数24.5%。设、答完整 1分
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 3Fe + 4CO2。(计算最终结果保留小数点后一位)
3Fe + 4CO2。(计算最终结果保留小数点后一位)