题目内容
(2011年浙江绍兴,35题)下列五种溶液:①NaOH 溶液、 ②Ba(OH)2溶液、③Na2SO4溶液、④稀硝酸、⑤混有少量硝酸的MgSO4溶液
(1)指出其中属于碱溶液的 (选填序号);
(2)若将Ba(OH)2溶液与Na2SO4溶液混合,产生沉淀质量是116.5克.需要20%的硫酸钠溶液多少克?
(3)若将Ba(0H)2溶液逐滴加人到混有少量硝酸的MgSO4溶液中,所得沉淀的质量与加入的
Ba(OH)2的质量变化符合下列图像的是 (选填序号)·

(1)指出其中属于碱溶液的 (选填序号);
(2)若将Ba(OH)2溶液与Na2SO4溶液混合,产生沉淀质量是116.5克.需要20%的硫酸钠溶液多少克?
(3)若将Ba(0H)2溶液逐滴加人到混有少量硝酸的MgSO4溶液中,所得沉淀的质量与加入的
Ba(OH)2的质量变化符合下列图像的是 (选填序号)·

(1)①②
(2)设需要硫酸钠质量为X,则
Ba(OH)2+Na2SO4=== BaSO4↓+2NaOH
142 233
X 116.5g
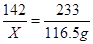 X=71g
X=71g
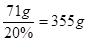
答:需要20%的硫酸钠溶液355克.
(3)C
(2)设需要硫酸钠质量为X,则
Ba(OH)2+Na2SO4=== BaSO4↓+2NaOH
142 233
X 116.5g
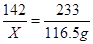 X=71g
X=71g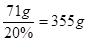
答:需要20%的硫酸钠溶液355克.
(3)C
分析:(1)根据碱的构成可知,碱是由金属阳离子和氢氧根离子构成的来解答;
(2)很据反应的先后顺序可知,有少量硝酸的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟硝酸中的H+发生中和反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀来分析解答.
解答:解:(1)因NaOH是由钠离子和氢氧根离子构成,Ba(OH)2是由钡离子和氢氧根离子构成,其它物质构成中不符合碱的概念,则①②是碱溶液,故答案为:①②;
(2)设需要硫酸钠质量为X,则
Ba(OH)2+Na2SO4=== BaSO4↓+2NaOH
142 233
X 116.5g
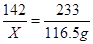 X=71g
X=71g
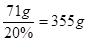
答:需要20%的硫酸钠溶液355克.
(3)因含少量硝酸的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟硝酸中的H+发生中和反应.待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀,即第一段沉淀是BaSO4,生成BaSO4的同时OH-和H+完全反应,产生水;(第一阶段,在硫酸根离子减少的同时,镁离子没有减少,此时由于是酸性环境,所以不能生成氢氧化镁沉淀).第二段斜率很大,是因为氢离子完全反应后,溶液中仍含有SO42-,同时还有 Ba(OH)2同时和MgSO4反应生成沉淀BaSO4和Mg(OH)2,所以沉淀多;(第二阶段由于加入的氢氧化钡和硫酸镁是正好成比例反应,导致第一阶段相对剩余的镁离子还是依旧剩余).第三段斜率又变小,溶液中SO42-反应完全,只有显得偏多的Mg2+与OH-生成Mg(OH)2沉淀,
直至曲线平直Ba(OH)2过量不再产生沉淀,故答案为:C.
(2)很据反应的先后顺序可知,有少量硝酸的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟硝酸中的H+发生中和反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀来分析解答.
解答:解:(1)因NaOH是由钠离子和氢氧根离子构成,Ba(OH)2是由钡离子和氢氧根离子构成,其它物质构成中不符合碱的概念,则①②是碱溶液,故答案为:①②;
(2)设需要硫酸钠质量为X,则
Ba(OH)2+Na2SO4=== BaSO4↓+2NaOH
142 233
X 116.5g
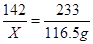 X=71g
X=71g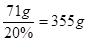
答:需要20%的硫酸钠溶液355克.
(3)因含少量硝酸的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟硝酸中的H+发生中和反应.待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀,即第一段沉淀是BaSO4,生成BaSO4的同时OH-和H+完全反应,产生水;(第一阶段,在硫酸根离子减少的同时,镁离子没有减少,此时由于是酸性环境,所以不能生成氢氧化镁沉淀).第二段斜率很大,是因为氢离子完全反应后,溶液中仍含有SO42-,同时还有 Ba(OH)2同时和MgSO4反应生成沉淀BaSO4和Mg(OH)2,所以沉淀多;(第二阶段由于加入的氢氧化钡和硫酸镁是正好成比例反应,导致第一阶段相对剩余的镁离子还是依旧剩余).第三段斜率又变小,溶液中SO42-反应完全,只有显得偏多的Mg2+与OH-生成Mg(OH)2沉淀,
直至曲线平直Ba(OH)2过量不再产生沉淀,故答案为:C.

练习册系列答案
相关题目