题目内容
【题目】海水晒盐得到的粗盐除去杂质后,除可做调料,还可以作为工业原料。某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的方程式为:2NaCl + 2H2O![]() 2NaOH + Cl2↑ + H2↑),这种工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。某兴趣小组同学对存放的该厂生产的烧碱样品产生兴趣,对该样品的成分进行了如下探究:
2NaOH + Cl2↑ + H2↑),这种工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。某兴趣小组同学对存放的该厂生产的烧碱样品产生兴趣,对该样品的成分进行了如下探究:
(提出问题)该烧碱样品中可能含有哪些杂质?
(猜想)甲同学:可能含有NaCl
乙同学:可能含有Na2CO3,乙同学猜想的依据是_________________。
(实验探究)为探究该烧碱样品的成分及样品的纯度(氢氧化钠在样品中所占的质量分数),甲、乙两同学通过思考分别设计了如下实验:
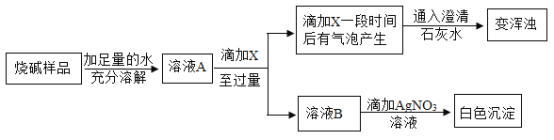
甲同学设计如下方案对烧碱样品的组成进行探究,请回答:
(1)试剂X应选用_________(填化学式)才能依据相应的现象得出正确结论。
乙同学设计了如下方案测定该烧碱样品的纯度:
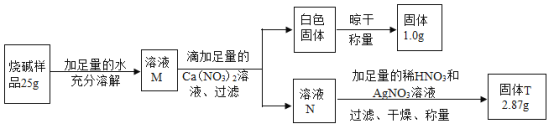
(2)滴加足量Ca(NO3)2的目的是__________________。
(3)请利用乙同学的实验数据,计算该样品中碳酸钠的质量,写出计算过程______________。
(4)该烧碱样品中氢氧化钠的质量分数为_____。(不写计算过程,结果精确到0.1%)
(5)实验结束后,两同学发现测得的该烧碱样品纯度低于工厂样品纯度,请从实验操作的角度分析,原因可能是_______________。
【答案】NaOH与CO2发生反应生成Na2CO3 HNO3 使溶液中的碳酸钠完全参加反应 1.06g 91.1% 过滤后的沉淀没有洗涤导致沉淀质量增大,杂质结果偏大,样品纯度降低
【解析】
猜想:
二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠;
实验探究:
硝酸和氢氧化钠反应生成硝酸钠和水,硝酸和碳酸钠反应生成硝酸钠和水、二氧化碳,硝酸和氯化钠不反应;向烧碱样品加足量的水溶解得到溶液A,向所得的溶液中逐渐加入稀硝酸至过量得到溶液B,一开始无明显现象,是稀硝酸和氢氧化钠反应,一段时间后产生能使澄清石灰水浑浊的气体,此时是稀硝酸和碳酸钠反应生成二氧化碳气体,因此样品中含有的杂质是碳酸钠;向溶液B中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有氯离子,即样品的杂质有氯化钠;试剂X应选用HNO3才能依据相应的现象得出正确结论。
(2)硝酸钙与碳酸钠反应生成碳酸钙沉淀和硝酸钠,滴加足量Ca(NO3)2的目的是使溶液中的碳酸钠完全参加反应。
(3)解:设该样品中碳酸钠的质量为x,即参加反应的碳酸钠的质量为x,硝酸钙和碳酸钠反应生成硝酸钠和碳酸钙沉淀,
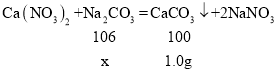
![]()
解得x=1.06g,
答:该样品中碳酸钠的质量为1.06g。
(4)解:设设该样品中氯化钠的质量为y,即参加反应的氯化钠的质量为y,氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠;
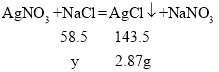
![]()
解得y=1.17g,
则样品中氢氧化钠的质量为25g-1.06g-1.17g=22.77g
则该烧碱样品中氢氧化钠的质量分数为![]()
答:该烧碱样品中氢氧化钠的质量分数为91.1%。
(5)实验结束后,两同学发现测得的该烧碱样品纯度低于工厂样品纯度,从实验操作的角度分析,原因可能是过滤后的沉淀没有洗涤导致沉淀质量增大,杂质结果偏大,样品纯度降低。