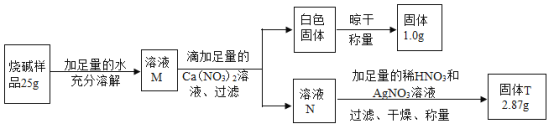
题目内容
【题目】用图装置进行实验。向三个充满二氧化碳的同体积的软质塑料瓶中分别加入等体积的三种液体。盖紧瓶盖,振荡,观察到三个瓶子均出现变瘪的现象。
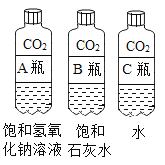
(1)B 瓶中的现象还能能观察到的现象是_______。
(2)A 瓶中反应的化学方程式为_______。
(3)三个瓶子变瘪的程度由大到小的顺序是_______。
【答案】石灰水变浑浊 2NaOH + CO2 =Na2CO3 + H2O ABC
【解析】
(1)二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,B 瓶中的现象还能观察到的现象是石灰水变浑浊。
(2)A 瓶中氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式为2NaOH + CO2 =Na2CO3 + H2O。
(3)向三个充满二氧化碳的同体积的软质塑料瓶中分别加入等体积的氢氧化钠溶液、饱和石灰水、水三种液体。三种液体中水的体积大致相等,水吸收二氧化碳相等;氢氧化钠的溶解度大于氢氧化钙,氢氧化钠溶液的浓度最大,吸收的二氧化碳最多,石灰水吸收二氧化碳第二多,水吸收二氧化碳最少。二氧化碳吸收越多,压强变化越大,瓶子变瘪程度越大。三个瓶子变瘪的程度由大到小的顺序是ABC。

练习册系列答案
相关题目