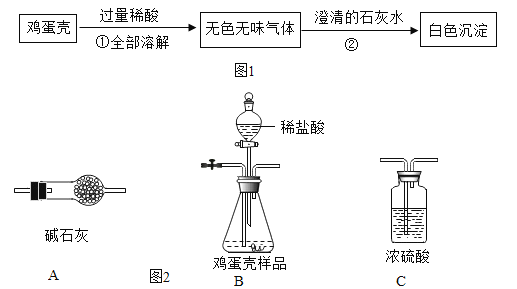
题目内容
【题目】现有等质量X,Y的两种金属,分别放入溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知X,Y在生成物中化合价均为+2价).则下列说法不正确的是( )
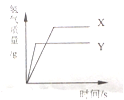
A. 生成氢气的质量:X>Y B. 相对原子的质量:X>Y
C. 金属活动性:Y>C D. 消耗硫酸的质量:X>Y
【答案】B
【解析】
试题A、根据反应生成H2的质量与反应时间的关系图所示,在两种金属完全反应后,放出H2的质量是X>Y,正确;
B、X、Y金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小;根据反应生成H2的质量与反应时间的关系图所示,在金属完全反应后,放出H2的质量是X>Y,因此可判断相对原子质量是Y>X,故说法正确;
C、根据反应生成H2的质量与反应时间的关系图所示,相同时间内Y放出氢气的质量大于X,可判断金属活动性顺序是Y>X,故说法错误;
D、金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:X>Y,故说法正确;
故选B.

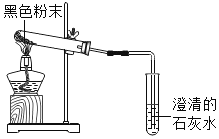
【题目】两他同学帮助老师整理实验室时,在标有“单质”的药柜中发现一瓶失去标签的黑色粉末A,在标有“氧化物”的药柜中发现另一瓶先去标签的黑色粉末B。
(提出问题)这两瓶黑色粉末A和B分别是什么物质?
(猜想)甲同学:A是铁粉,B是二氧化锰。
乙同学:A是炭粉,B是氧化铜。
(查阅资料)炭粉和二氧化锰均不能与稀硫酸反应;![]()
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
①取少量A粉末于试管中,加入适量稀硫酸。 | 黑色粉末不溶解。没有气体产生。 | A粉末一定不是______。 |
②取少量B粉末于试管中,如入适量稀硫酸。 | ______。 | B粉末是氧化铜。 |
(反思与拓展)
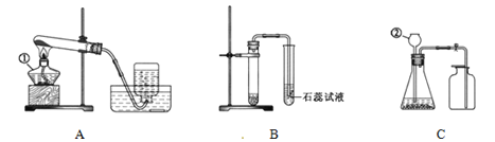
(1)将这两种黑色粉末混合加热(如图),观察到黑色粉末逐渐变为红色.澄清石灰水变浑浊,黑色粉末A和B发生反应的化学方程式为______。实验结束时,先将导管移出.再熄灭酒精灯的原因是______
(2)乙同学的猜想是正确。