题目内容
【题目】在研究酸和碱的化学性质时,同学发现稀 H2SO4 与 NaOH溶液混合后无明显现象产生,于是设计并完成了如下实验方案
方案一:测定稀H2SO4与NaOH溶液混合前后的pH。
(1)将pH试纸伸入某 NaOH溶液中测定NaOH溶液的 pH,测得 pH_____7(选填“大于”“等于”或“小于”);
(2)将一定量的稀 H2SO4加入该 NaOH溶液中,混合均匀后测定其 pH,pH=7
方案二:向盛有 NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸,观察到溶液由红色变成无色
结论:稀 H2SO4与 NaOH溶液发生了化学反应,反应的化学方程式为:_____;上述实验操作中错误的是_____
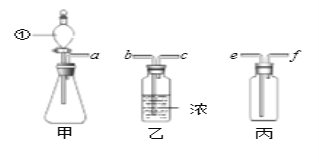
(3)甲酸(HCOOH)是一种具有挥发性的酸,甲酸在热的浓硫酸中会分解生成两种氧化物:CO和_____(写化学式)如图是制取CO,用CO还原氧化铁并检验气体产物,同时收集尾气中的CO的实验装置
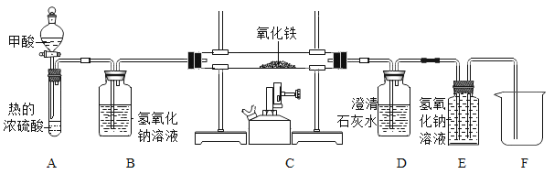
①写出C装置内玻璃管中发生反应的化学方程式:_____
②若没有B装置,则不能达到检验气体产物的目的,原因是什么_____?
③E装置可起到收集 CO的作用,实验结束时,E中有部分溶液进入到F烧杯中,请设计实验证明该溶液溶质的成分中含有NaOH,写出实验步骤、现象和结论_____
(4)工业上冶炼 150吨含杂质为 2%的生铁,需要含杂质20%的赤铁矿石多少吨___?
【答案】大于 2NaOH+H2SO4=Na2SO4+2H2O 不能将pH试纸伸入某 NaOH溶液中测定NaOH溶液的 pH,会污染溶液; H2O Fe2O3+3CO![]() 2Fe+3CO2 甲酸(HCOOH)是一种具有挥发性的酸,若没有B装置,甲酸先和D装置中石灰水反应,D中石灰水可能不会变浑浊,无法检验C装置生成的二氧化碳。 实验步骤:取适量F烧杯中液体于试管中,加入足量的氯化钙溶液;取上层清液加酚酞;
2Fe+3CO2 甲酸(HCOOH)是一种具有挥发性的酸,若没有B装置,甲酸先和D装置中石灰水反应,D中石灰水可能不会变浑浊,无法检验C装置生成的二氧化碳。 实验步骤:取适量F烧杯中液体于试管中,加入足量的氯化钙溶液;取上层清液加酚酞;
实验现象:有白色沉淀产生;(碳酸钠能与氯化钙反应产生氯化钠和碳酸钙白色沉淀;)滴入酚酞的上层清液变红色;(酚酞遇碱性溶液变红)。
实验结论:说明原试管的溶液中含有氢氧化钠。 262.5
【解析】
方案一:(1)将pH试纸伸入某 NaOH溶液中测定NaOH溶液的 pH,氢氧化钠显碱性,测得 pH大于7;
(2)将一定量的稀 H2SO4加入该 NaOH溶液中,混合均匀后测定其 pH,pH=7
方案二:向盛有 NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸,观察到溶液由红色变成无色
结论:稀 H2SO4与 NaOH溶液发生反应产生硫酸钠和水的化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O;上述实验操作中错误的是:不能将pH试纸伸入某 NaOH溶液中测定NaOH溶液的 pH,会污染溶液;应该用干燥、结晶的玻璃棒蘸取待测液,滴在pH试纸上,产出颜色变化,与标准比色卡对比;
(3)甲酸(HCOOH)是一种具有挥发性的酸,甲酸在热的浓硫酸中会分解生成两种氧化物:该反应中甲酸含有碳、氢、氧三种元素,根据化学变化中元素守恒,应是CO和H2O
①C装置内玻璃管中一氧化碳高温条件下与氧化铁发生反应产生铁和二氧化碳的化学方程式:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
②若没有B装置中的氢氧化钠溶液,则不能达到检验气体产物的目的,原因是:甲酸(HCOOH)是一种具有挥发性的酸,若没有B装置,甲酸先和D装置中石灰水反应,D中石灰水可能不会变浑浊,无法检验C装置生成的二氧化碳。
③E装置中可起到收集 CO的作用,同时能吸收二氧化碳气体,(二氧化碳能与氢氧化钠反应产生碳酸钠溶液)实验结束时,E中有部分溶液进入到F烧杯中,设计实验证明该溶液溶质的成分中含有NaOH;
实验步骤:取适量F烧杯中液体于试管中,加入足量的氯化钙溶液;取上层清液加酚酞;
实验现象:白色沉淀产生;(碳酸钠能与氯化钙反应产生氯化钠和碳酸钙白色沉淀;)滴入酚酞的上层清液变红色;(酚酞遇碱性溶液变红)。
实验结论:说明原试管的溶液中含有氢氧化钠;
(4)解:设需要需要含杂质20%的赤铁矿石x。
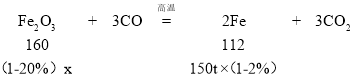
![]() x=262.5t。
x=262.5t。
需要含杂质20%的赤铁矿石262.5t。