题目内容
【题目】有一包白色粉末可能含 FeCl3、Na2CO3、Ca(OH)2、CaCO3 中的一种或几种,为了确定该白色粉末的成分,化学兴趣小组同学进行了如下的探究活动:
(提出问题)该白色粉末中含有哪些物质?
(查阅资料)BaCl2 溶液、Ca(NO3)2 溶液和 NaNO3 溶液呈中性。
(实验探究)(1)甲同学的探究步骤如下:
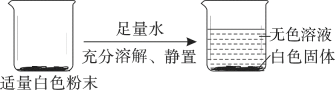
甲同学得出结论:原白色粉末中一定没有_______________,一定有 CaCO3。
(2)乙同学取(1)中少量上层无色溶液于试管中,加入适量的稀盐酸,得到原白色粉末中一定有Na2CO3,则他观察到的实验现象_________________。
(交流讨论)丙同学不同意甲同学得到原白色粉末中一定含有 CaCO3 的结论,他认为碳酸钙还有可能来自于白色粉末成分间发生化学反应的产物,该反应的化学方程式为____________。
(实验验证)为了确认白色粉末的成分,丁同学另取(1)中少量上层无色溶液于试管中做了如下实验:先加入过量的氯化钙溶液,产生白色沉淀;再加入无色酚酞溶液,溶液变红色。由此得出,则原固体混合物中一定还含有的成分是______________(化学式)。
(拓展反思)①丁同学实验中加入过量氯化钙溶液的目的是为了完全除去碳酸钠,以下物质中可以代替氯化钙溶液,同样可以顺利进行原实验的是____________(填字母)。
A、BaCl2 溶液 B、Ca(NO3)2 溶液 C、Ca(OH)2 溶液 D、稀盐酸
②该包白色固体粉末的可能情况有_______种。
【答案】FeCl3 有气泡产生 Na2CO3 + Ca(OH)2= CaCO3↓+2NaOH Ca(OH)2 AB 两
【解析】
[实验探究]
(1)用足量的水溶解白色粉末,得到无色溶液和白色固体,则原白色粉末中一定没有FeCl3,因为FeCl3溶液是黄色的。
(2)取(1)中少量上层无色溶液于试管中,加入适量的稀盐酸,可得出结论原白色粉末中一定有Na2CO3,碳酸钠与盐酸反应,生水氯化钠、水和二氧化碳气体,则可观察有气泡产生。
[交流讨论]
在实验(1)中观察到有白色固体,该白色固体不一定是原白色粉末含有的碳酸钙,也可能来自于白色粉末碳酸钠与氢氧化钙反应的产物,该反应的化学方程式为Na2CO3 + Ca(OH)2= CaCO3↓+2NaOH。
[实验验证]
取(1)中少量上层无色溶液于试管中做了如下实验:先加入过量的氯化钙溶液,产生白色沉淀,确定溶液中含有碳酸钠并除去碳酸钠;再加入无色酚酞溶液,溶液变红色,说明溶液呈碱性,则溶液中含有氢氧化钠。由此得出,则原固体混合物中一定还含有Ca(OH)2。
[拓展反思]
①A、用BaCl2 溶液除去溶液中的碳酸钠,氯化钡与碳酸钠反应生成碳酸钡沉淀和氯化钠,而氯化钠溶液呈中性,符合题意;
B、用Ca(NO3)2 溶液除去溶液中的碳酸钠,硝酸钙与碳酸钠反应生成碳酸钙沉淀和硝酸钠,而硝酸钠溶液呈中性,符合题意;
C、用Ca(OH)2 溶液子除去溶液中的碳酸钠,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠溶液呈碱性,会干扰其他成分的检验,不符合题意;
D、用稀盐酸溶液中的碳酸钠,盐酸不但能与碳酸钠反应,也能中和溶液中的碱性,使溶液呈中性或酸性,干扰其他成分的检验,不符合题意。故选AB。
②通过以上研究可知,该包白色固体粉末的可能情况有两种:一是碳酸钠和氢氧化钙;二是碳酸钠、氢氧化钙和碳酸钙。

 阅读快车系列答案
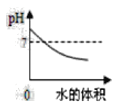
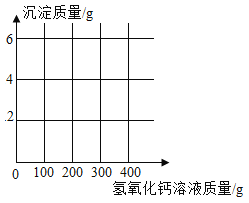
阅读快车系列答案【题目】实验室有一瓶久置的氢氧化钠固体,李璧凝同学想了解其变质情况,称取 9.3g 干燥的样品,加水使其完全溶解,然后向其中逐滴滴加氢氧化钙溶液,所得沉淀质量与加入氢氧化钙溶液质量关系如下表所示:
实验编号 | ① | ② | ③ | ④ |
氢氧化钙溶液质量/g | 100 | 200 | 300 | 400 |
沉淀质量/g | 2 | m | 5 | 5 |
(1)实验②中 m 的数值为_________________。
(2)计算该氢氧化钠固体中碳酸钠的质量分数____________。(写出计算过程,结果精确到 0.1%)
(3)请在下图中画出生成沉淀质量随加入氢氧化钙溶液质量变化的曲线图,并标出图中的必要数据______________。
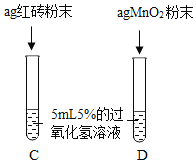
【题目】课本第二单元课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。
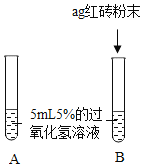
[提出问题]红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
[实验探究]
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象,B中产生大量能使带火星木条复燃的气体 | ①产生的气体是_ ②___ |
II.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ①又产生大量能使带火星木条复燃的气体 ②滤渣质量等于ag | 红砖粉末的__在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡且 __ | 红砖粉末的催化效果没有二氧化锰粉末好 |
[拓展应用]
己知CuSO4也可作为过氧化氢分解的催化剂。向101g 一定溶质质量分数的过氧化氢溶液中加入2gCuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气__g。