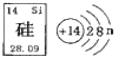
题目内容
【题目】工业上利用某废渣(含FeSO4、Fe2(SO4)3及少量CaO和MgO)制备高档颜料铁红(主要成分为Fe2O3)和回收(NH4)2SO4.具体生产流程如下:

(背景信息)
a 氧化还原反应中,会有元素化合价发生变化。
b 3Fe2(SO4)3+12NH3H2O=(NH4)2Fe6(SO4)4(OH)12↓(铵黄铁矾晶体)+5(NH4)2SO4
(1)步骤③中操作Y的名称是_______________。
(2)加入物质X溶解废渣,X应选用______________(填序号)。
A 盐酸 B 硫酸 C 氨水 D 氢氧化钠
步骤①酸浸时,生成盐的化学方程式为___________________________(任写一个)。
(3)步骤②通入氧气氧化的目的是_________________;工业上对该操作控制在4小时左右为宜,根据如图有关数据分析,影响Fe2+氧化率的变化规律:________
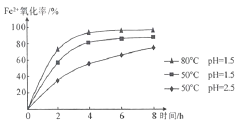
【答案】过滤 B MgO+H2SO4=MgSO4+H2O(合理即可) 将硫酸亚铁转化成硫酸铁 温度越高,pH值越小,氧化率越高
【解析】
(1)过滤可以将不溶性固体从溶液中分离出来,所以步骤③中操作Y的名称是过滤;
(2)加入的物质既需要可以溶解金属氧化物,又不能引入新的杂质,金属氧化物能与酸溶液反应生成盐和水,为了不引入杂质,应使用硫酸,所以加入物质X溶解废渣,X应选用硫酸,故选B;氧化镁和硫酸反应生成硫酸镁和水,化学方程式为:MgO+H2SO4=MgSO4+H2O;
(3)该反应过程中制取的是高档颜料铁红氧化铁,所以步骤②通入氧气氧化的目的是:将硫酸亚铁转化成的硫酸铁,通过分析图象中的数据可知,影响Fe2+氧化率的变化规律是:温度越高,pH值越小,氧化率越高。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目