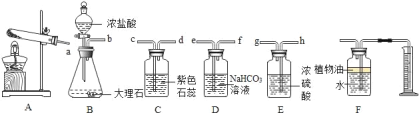
题目内容
【题目】如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.

该钙片主要成分碳酸钙,主要成分碳酸钙由_____种元素组成.碳酸钙中各元素的质量比为_____.
每片钙片中至少含钙元素的质量为_____.
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一;甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体
的量来进行计算.
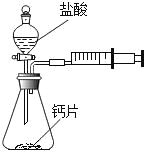
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为_____.
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.
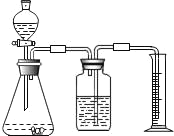
(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会_____(填偏大或偏小),你认为他们的理由是_____,你的改进方案是_____;广口瓶内原有的空气对实验结果_____(填“有”或“没有”)影响
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是_____.
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下
实验步骤.
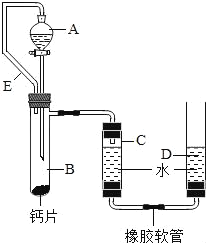
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中
液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是:_____;
(2)同学们都认为丙同学的设计中最经典的是连接仪器A和仪器B的橡胶管E,你认为橡胶管E的作用是:_____;
(3)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管,_____,则气密性良好;
(4)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验:清判断并说明理由_____.
实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是_____(填“真实”或“不真实”)的.(最后一空不需要写计算过程)
【答案】三 10:3:12 0.6g 样品取用过多,反应产生的气体多,会导致注射器活塞被顶出;取用样品过少,反应产生的气体太少,无法测量 偏小 会有部分二氧化碳溶解在水中 在水面上滴一层植物油 没有 滴入的盐酸会占有体积,所以导致进入量筒的液体包含了分液漏斗中滴入锥形瓶的盐酸的体积 使样品中的碳酸钙完全反应 使仪器A和仪器B中的气体压强相同,便于液体滴下,且消除滴下液体对气体体积的影响 静止片刻后,C、D液面仍存在高度差 重新实验,中途添加酸时,会造成气体逸散,影响气体体积的精确测量 真实
【解析】
根据碳酸钙的化学式CaCO3确定含三种元素,m钙:m碳:m氧=10:3:12,1.5g×![]() =0.6g.
=0.6g.
故答案:三 m钙:m碳:m氧=10:3:12;0.6g
方案一:由图示知通过注射器最后的数据确定,样品取用过多,反应产生的气体多,会导致注射活塞被顶出;取用样品过少,反应产生的气体太少,无法测量.
故[方案一]答案:样品取用过多,反应产生的气体多,会导致注射器活塞被顶出;取用样品过少,反应产生的气体太少,无法测量.
方案二:(1)二氧化碳能溶于水,故答案:偏小,会有部分二氧化碳溶解在水中,在水面上滴一层植物油;没有;
(2)滴入的盐酸会占有体积,所以导致进入量筒的液体包含了分液漏斗中滴入锥形瓶的盐酸的体积.
方案三:(1)钙片磨碎后增大了与酸的接触面积,使反应更完全充分,故答案:使样品中的碳酸钙完全反应;
(2)AB之间接上导管E使AB连接在一起,故答案:使仪器A和仪器B中的气体压强相同,便于液体滴下,且消除滴下液体对气体体积的影响;
(3)装置气密性良好的话在C、D两管中装好水且液面相平,提高D管静止一段时间后CD液面仍存在高度差证明气密性良好,故答案:静止片刻后,C、D液面仍存在高度差;
(4)重新加酸打开装置会有气体溢出,故答案:重新实验,中途添加酸时,会造成气体逸散,影响气体体积的精确测量
[实验结论]:若十片含碳元素质量为1.5×10×![]() =1.8g,生成二氧化碳质量为1.8÷
=1.8g,生成二氧化碳质量为1.8÷![]() =6.6g<6.82g,
=6.6g<6.82g,
故答案:真实.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】分析处理图表中的信息是学习化学的一种重要方法.
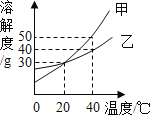
(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
①40℃时,氯化钠的溶解度为_____g.
②碳酸钠的溶解度随温度的升高而_____(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是_____(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为_____(计算结果精确到0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是_____.
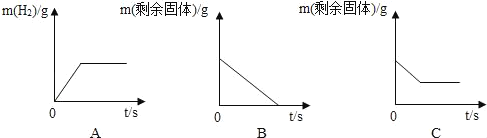
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式_____.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是_____(填标号).
【题目】下列方框内是对某一主题知识的描述.其内容全部正确的一组是( )
安装燃气热水器———定要配有烟道 预防煤气中毒———–室内放一盆水 劣质装饰材料—甲醛等超标致室内污染 |
减少汽车尾气污染——使用乙醇汽油 深埋丢弃废旧电池——造成水土污染 大理石雕塑被腐蚀——温室效应所致 |
食用水果蔬菜———–可补充维生素 食用“加铁酱油”———可预防贫血 食用加碘盐———可预防甲状腺肿大 |
氮气———-可做焊接金属的保护气
油罐车尾铁链——–防静电引燃油料 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()