题目内容
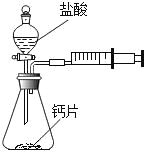
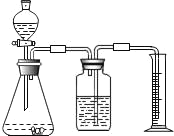
【题目】海水中含有丰富的氯化镁,如图是从海水中提取镁的简单流程.在提取Mg的过程中,
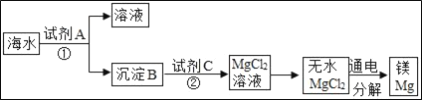
(1)试剂A最好选用_____(从我国有丰富的石灰石资源考虑).沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为_____;
(2)由无水MgCl2制取Mg的化学方程式为_____;
(3)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:_____.
【答案】Ca(OH)2(氢氧化钙) Mg(OH)2 MgCl2![]() Mg+Cl2↑ 后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
Mg+Cl2↑ 后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
【解析】
(1)试剂A最好选用氢氧化钙,这是因为氢氧化钙价格较低,并且制取氢氧化钙的原料丰富;
沉淀B是氢氧化镁,试剂C是稀盐酸,氢氧化镁和稀盐酸反应生成氯化镁和水,发生的是中和反应,氢氧化镁的化学式为Mg(OH)2.
故填:氢氧化钙;Mg(OH)2.
(2)由无水MgCl2制取Mg的化学方程式为:MgCl2![]() Mg+Cl2↑;
Mg+Cl2↑;
(3)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液相比,海水中的MgCl2浓度低,并且含有多种杂质.
故填:海水中的MgCl2浓度低,并且含有多种杂质.

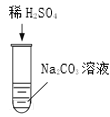
【题目】某化学兴趣小组在实验室里探究某些酸、碱、盐之间是否发生复分解反应。
(实验与探究)填写下表各空。
内容 |
|
|
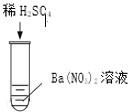
溶液③是_____ |
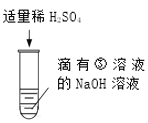
现象 | 有气泡产生 | 现象是_____。 | 溶液由红色恰好变成无色 |
实验 解析 | 化学方程式是 _____。 | 化学方程式: H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 |
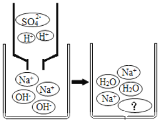
图中“?”代表的离子是 _____(填离子符号)。 |
结论 | 生成物中有气体或有_____或有水生成时,复分解反应可以发生。 | ||
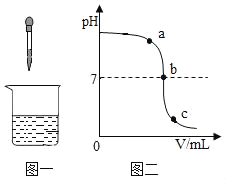
(拓展与应用)将实验一、二、三反应后的上层清液倒入同一洁净的烧杯中(沉淀不倒入)后续实验及现象如图:
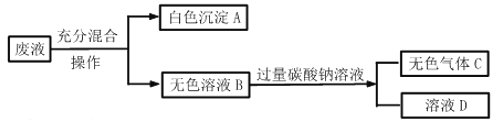
(1)无色溶液B的pH_____7(填“<”、“>”或“=”)。
(2)白色沉淀A是_____。
(3)无色溶液B中除了含有酚酞外,一定还含有的溶质是_____。