题目内容
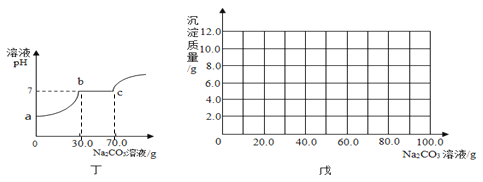
【题目】取碳酸钙和硫酸钡的混合物15.0 g于烧杯中,将150.0 g的稀盐酸平均分成三次加入烧杯中,加入稀盐酸与烧杯中固体的质量关系如下图所示,请完成下列问题:
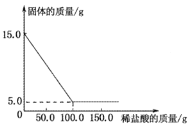
(1)该混合物中硫酸钡的质量为__________g;
(2)所加稀盐酸的溶质质量分数是 ______;
(3)求恰好完全反应时所得溶液中溶质的质量分数_______(写出计算过程,精确到0.1%)。
【答案】57.3%10.5%
【解析】
(1)碳酸钙可以与稀盐酸反应,硫酸钡不能与稀盐酸反应,故最终剩余固体的质量就是硫酸钡的质量,故硫酸钡的质量为5.0g;
(2)由图可知,10g 的碳酸钙与100g 的稀盐酸恰好完全反应,设100g稀盐酸中溶质的质量为x
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 73
10g x
![]() =
=![]()
x=7.3g
稀盐酸的质量分数为![]() ×100%=7.3%
×100%=7.3%
(3)设恰好完全反应后生成二氧化碳的质量为y,生成氯化钙的质量为m
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 111 44
10g m y
![]() =
=![]() =
=![]()
m=11.1g,y=4.4g
故反应后溶液中溶质的质量分数为![]() ×100%=10.5%。
×100%=10.5%。
答:硫酸钡的质量为5.0g;稀盐酸的质量分数为7.3%,反应后溶液中溶质的质量分数为10.5%。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】为测定一种含碳酸钙的“石头纸”中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品,分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
则求:(1)表中X的值为________;
(2)求样品中碳酸钙的质量分数________;
(3)烧杯④中物质充分反应后所得溶液的质量为____g。